Guideline
Diabetes mellitus
Zuletzt revidiert: 02/2021 Letzte Änderung: 03/2024
- Guideline als PDF
- Guideline Kurzversion
- Algorithmus: Blutzuckersenkende Therapie bei Typ-2-Diabetes
- Augenärztliche Kontrollen bei Diabetes
- Merkblatt Diabetes und Autofahren
- Diabetes Kontrollblatt Equam
- Diabetes Kontrollblatt

Aktualisierung 09/2023
- Vorgehen bei Lieferengpässen von Ozempic® oder Trulicity® auf Rybelsus® oral (–> Kap. 3.3.1).
Aktualisierung 03/2024
- Neue Empfehlungen zur Antidiabetika-Kombinationstherapie (Therapieeskalation)
(–> Kap. 3.3) - Der Abschnitt orale Antidiabetika wurde vollständig überarbeitet und aktualisiert
(–> Kap. 3.3.1) - Der Abschnitt Insulintherapie wurde vollständig überarbeitet und aktualisiert (–> Kap. 3.3.2).
1. Klassifikation (1)
Typ-1-Diabetes
- Immunologisch vermittelte Beta-Zellzerstörung, die zu einem absoluten Insulinmangel führt
- LADA (Latent Autoimmune Diabetes of the Adults) entspricht dem Late-Onset-Typ-1-Diabetes.
Typ-2-Diabetes
- 90 % aller erwachsenen Diabetiker
- Insulinresistenz mit relativem Insulinmangel; im Verlauf kommt es aufgrund Basalzellerschöpfung zu Insulinbedürftigkeit (5 %/Jahr der Typ-2-Diabetiker benötigen Insulintherapie).
MODY (Maturity Onset Diabetes of the Young)*
Daran denken bei
- Jungen Patienten (< 30 J.)
- Positiver FA für Diabetes
- Fehlendem Übergewicht
* MODY: Genetisch bedingte Störungen der Insulinsekretion. Da es sich um Genmutationen handelt, fällt der MODY bei jungen Patienten im Alter < 30 J. auf, mit positiver FA für Diabetes, die nicht in die Gruppe Typ-1- oder Typ-2-Diabetes passen (fehlende Autoantikörper, keine Adipositas). Die Unterscheidung ist relevant, da diese Patienten zum Teil sehr gut auf Sulfonylharnstoffe ansprechen.
Gestationsdiabetes
- 30–60 % der Frauen werden im späteren Leben einen Typ-2-Diabetes entwickeln.
Andere spezifische Diabetes-Typen
- Medikamentös: Glukokortikoide, Neuroleptika, Interferon-alpha, usw.
- Endokrinopathien: M. Cushing, Phäochromozytom, Akromegalie.
2. Diagnostik
Anamnese/körperliche Untersuchung
Familienanamnese
- Diabetes, Übergewicht, Bluthochdruck, Herzinfarkt, Schlaganfall, Nierenerkrankung.
Körperliche Untersuchung
- Grösse, Gewicht, kardiovask. System, Blutdruck, periphere Arterien, Fussuntersuchung.
Labor
- Plasma-Glukose, HbA1c, Kreatinin, Kalium, Natrium, GOT, GPT, Urinstatus für Mikroalbuminurie, TSH bei Typ-1-Diabetes, allenfalls Lipidstatus.
Diagnostische Kriterien (1)
Diabetes mellitus
- HbA1c ≥ 6,5 % ist diagnostisch
- Bei Gelegenheits-Plasmaglukose: ≥ 11,1 mmol/l und klassische Symptome (Polyurie, Polydipsie, Gewichtsverlust) und Nüchtern-Plasmaglukose: ≥ 7,0 mmol/l soll HbA1c gemessen werden (oder Kontrolle der Messergebnisse alle 3 Monate).
Screening auf Diabetes
- Bei asymptomatischen Personen sind Routine-Screenings mittels Nüchtern-Plasmaglukose oder HbA1c-Bestimmung (standardisierte, validierte Methode nach DCCT oder IFCC) empfohlen.
Der OGTT wird nur in der Schwangerschaft durchgeführt - Die Diagnose ist durch eine zweite Messung an einem anderen Tag zu bestätigen.
Cave: HbA1c ist für das Screening nur möglich, sofern keiner der folgenden Faktoren vorliegt: Hämoglobinopathien, erhöhter Ec-Turnover (wie hämolytische Anämie, Bluttransfusionen, subklinische Hämolyse bei HIV), schwere Leber- oder Niereninsuffizienz, Gestationsdiabetes, CF-assoziierter Diabetes, Einnahme von hohen Dosen Vitamin C und E.
Kategorien mit erhöhtem Risiko, einen Diabetes zu entwickeln (Prä-Diabetes)
- IFG (impaired fasting glucose): Nüchternplasmablutzucker 5,6–6,9 mmol/l,
HbA1c: ≥ 5,7–6,4 %
Hinweise
„Prä-Diabetes‟ (IFG, HbA1c: 6,0–6,4 %) geht häufig in einen Diabetes über (4). Diesen Patienten sollte eine Lifestyle-Anpassung empfohlen werden (49); in einzelnen Fällen Metformin.
Maturity Onset Diabetes of the Young (MODY)
- Typischerweise junge (< 30 J.) und schlanke Patienten, oft mit positver FA für Diabetes. Bei vermutetem Typ-1-Diabetes zunächst Antikörper bestimmen –> Anti-GAD und Anti-IA2 sowie C-Peptid. Bei fehlenden Antikörpern und C-Peptid > 500 pmol/l mit fehlendem Übergewicht an MODY denken; genetische Abklärung (z. B. in Exeter, UK oder Genf) bringt kaum Zusatznutzen, da sich an der Therapie nichts ändert; die Kosten (mind. CHF 1‘000.–) werden i. d. R. nicht von den KK übernommen.
Screening
Bei allen Personen ab 40 J. alle drei Jahre (6, 8). Bei erhöhtem Risiko auch früher und in kürzeren Intervallen (alle 1–3 Jahre). Folgende Kriterien begründen ein erhöhtes Risiko (–> s. a. mediX GL Check-up)
- Positive Familienanamnese
- Status nach Gestationsdiabetes oder Geburtsgewicht eines Kindes > 4’100 g
- IFG/oder HbA1c 6,0–6,4 % in der Anamnese
- Neu: Bei allen übergewichtigen oder adipösen Erwachsenen im Alter zwischen 35–70 Jahre (alle 3 Jahre) –> s. a. US Preventive Services Task Force
- Arterielle Hypertonie
- Dyslipidämie
- Bekanntes polyzystisches Ovarsyndrom (PCOS).
3. Therapie
3.1. Therapieziele (3, 6, 7–10, 42)
- Individualisierte Therapieziele gemeinsam mit Patienten festlegen für Lebensstil(änderungen), Glukosestoffwechsel, Lipidstatus, Körpergewicht, Blutdruck. Dabei sollen u. a. Lebensalter, andere Erkrankungen, soziale Situation, Lebensqualität berücksichtigt werden ( Tabelle 1)
- HbA1c-Ziel
- 6,5–7,0 % bei jungen Patienten (bis 60 J.)
- Bei älteren (> 80 J.), multimorbiden Patienten oder bei Patienten mit geringer Lebenserwartung kann ein HbA1c von 8,0–9 % angemessen sein. Hypoglykämien sollten vermieden werden, insbesondere bei Patienten mit Atherosklerose und bei älteren Patienten.
- Faustregel: Jüngere Patienten mit Typ-2-Diabetes können von strengerer Blutzuckereinstellung profitieren (HbA1c < 7 %).
Tabelle 1: Therapieziele bei Typ-1- und Typ-2-Diabetes
|
|
Typ-1-Diabetes |
Typ-2-Diabetes |
|
Blutdruck |
< 140/90 mmHg* |
< 140/90 mmHg* |
|
HbA1c** |
Individuell 6,5–7 % ist bei jungen Patienten anzustreben |
Individuell 6,5–8,5 %
|
|
Nüchtern-BZ** |
< 7 mmol/l (Plasma) |
< 7 mmol/l (Plasma) |
|
Postprandialer BZ** |
< 10 mmol/l |
Je nach definiertem HbA1c, i. d. R. jedoch |
|
LDL-Cholesterin |
Wie bei Typ-2-Diabetes |
Bei allen > 40-Jährigen bis 75 Jahre****
Bei < 40-Jährigen: Nur bei kv RF |
|
Bewegung |
Wie bei Typ-2-Diabetes |
Täglich 30–60 min |
* Bei Diabetikern < 65 Jahre wird ein BD < 130/80 mmHg empfohlen, wenn die Therapie vertragen wird.
** Die Werte beziehen sich auf die Messung im Blutplasma. Kapilläre und Plasma-Messung weichen jedoch nur minimal voneinander ab, sodass auch kapillär gemessen werden kann. Nur bei Gestationsdiabetes muss es Plasma sein, da hier eine minimale Erhöhung schon die Diagnose GDM zur Folge haben kann. Eine BZ-Kontrollmessung ist in der Praxis nicht unbedingt erforderlich. Zur Routinekontrolle reicht die Bestimmung von HbA1c.
*** Eine fixe Statindosis („fire and forget“) sollte nur bei Patienten gewählt werden, bei denen eine treat-to-target-Strategie nicht möglich ist.
**** Bei über 75-Jährigen sollte bei Erstdiagnose eines Diabetes nicht primärprophylaktisch mit einem Statin begonnen werden. Ob es in dem Alter zur Primärprophylaxe abgesetzt werden soll, ist noch Gegenstand von Diskussionen. Zur Lipdsenkenden Therapie s. a. mediX GL Hyperlipidämie.
Blutzucker-Selbstmessung
- Ein Nutzen regelmässiger täglicher BZ-Selbstmessung bei Typ-2-Diabetikern ohne Insulintherapie konnte nicht nachgewiesen werden (3, 20). Es wird nicht empfohlen, beim Typ-2-Diabetes ohne Insulin den BZ täglich zu messen, stattdessen eher Orientierung am HbA1c. Jedoch können nach Absprache mit dem Arzt gewisse Messungen Sinn machen (z. B. ein 4-Punkt-Tagesprofil pro Woche, d. h. vor dem Frühstück, Mittagessen, Abendessen und vor der Bettruhe)
- BZ-Selbstmessung ist aber bei Typ-2-Diabetikern in bestimmten Situationen erforderlich, etwa bei labiler Stoffwechsellage mit häufiger Unterzuckerung, bei stark veränderter Ernährung (z. B. Durchfall) oder vor einer Autofahrt (siehe Kap. 3.5.)
- Bei Typ-1-Diabetes sollte vor dem Essen, vor dem Sport, vor dem Autofahren oder anderen potentiell gefährlichen Tätigkeiten, nach Behandlung einer Hypoglykämie und vor dem Schlafengehen gemessen werden
- Für Typ-1-Diabetiker bedeutet ein CGMS (Continuous Glucose Monitoring Systems, z. B. freestyle libre oder Dexcom) eine grosse Entlastung und sollte ihnen angeboten werden. Auch für Typ-2-Diabetiker mit Basis-Bolus-Schema kann ein freestyle libre erwogen werden, da das kapilläre Messen für alle Diabetiker mühsam ist. Bedingungen freestyle libre: Mindestens 4 Insulininjektionen pro Tag (d. h. Basis-Bolus); kann nur von einem Diabetologen verordnet werden.
Diabetes-Übersichtsblatt
Das Therapieziel wird mit dem Patienten gemeinsam festgelegt und im Diabetes-Pass eingetragen
|
1. Sehr gute Einstellung (HbA1c: 6,5–7,0 %) |
Schwangerschaft, Kinder, schwere Retinopathie, Organtransplantationen, schmerzhafte Neuropathie |
|
2. Gute Einstellung (HbA1c: 7,0–7,5 %) |
Ziel für die meisten Diabetiker |
|
3. Symptomatische Therapie |
Sehr alte Patienten, Polymorbidität |
Hinweis: Die Diabeteskontrollblatt-Vorlage (Equam-Version) ist separat publiziert.
3.2. Nicht-pharmakologische Massnahmen
- Diabetes- und Ernährungsberatung für alle Patienten
- Lifestyle-Intervention: Langfristige Ernährungsumstellung, regelmässige körperliche Aktivität, relativ geringe Gewichtsabnahme bei Übergewicht/Adipositas (ca. 5–10 %) sind wirksamer als orale Antidiabetika (6).
3.3. Medikamentöse Therapie
Hinweise zur Therapiestrategie
- Da Lifestyleveränderungen allein oft nicht zum Ziel führen, kann auch sofort mit einer BZ-senkenden medikamentösenTherapie begonnen werden. Bei HbA1c-Werten nahe dem Zielkorridor sollten aber zunächst ausschliesslich nicht-medikamentöse Massnahmen versucht werden
- Das empfohlene therapeutische Vorgehen stellt Metformin, SGLT-2 Hemmer und GLP-1-Agonisten in den Vordergrund (s. a. Algorithmus, Tabelle 2 und nachfolgender Text)
Algorithmus: Blutzuckersenkende Therapie bei Typ-2-Diabetes
|
BZ-Therapieziel individuell festlegen |
|
|
Basistherapie |
|
|
BZ-senkende Pharmakotherapie |
|
Je nach HbA1c sowie krankheits- und personenspezifischen Faktoren
⇒ Bei Patienten mit anfänglichem HBA1c < 8,5 % je nach Motivation für Ernährungsumstellung/körperliche Aktivität mit Metformin-Monotherapie oder Zweierkombination beginnen |
|
Monotherapie mit Metformin (1. Wahl) |
|
Bei Metformin-Unverträglichkeit: SGLT-2-Hemmer oder GLP-1 Analoga im Vordergrund |
|
Zweierkombinationen |
|
|
Wenn individuelles HbA1c-Ziel nicht erreicht wird |
|
Dreierkombinationen |
|
Metformin + SGLT-2 + GLP-1 bevorzugte Kombination, cave: KoGu.
Werden Bedinungen nicht erfüllt
Beachte: Sulfonylharnstoffe werden offiziell von der SGED nicht mehr empfohlen; Einsatz in Ausnahmefällen aber möglich (z. B. Unverträglichkeit anderer OAD) |
|
Wenn individuelles HbA1c-Ziel nicht erreicht wird |
|
Insulintherapie |
|
Tabelle 2: SGED–Empfehlungen zur Diabetestherapie (2023)
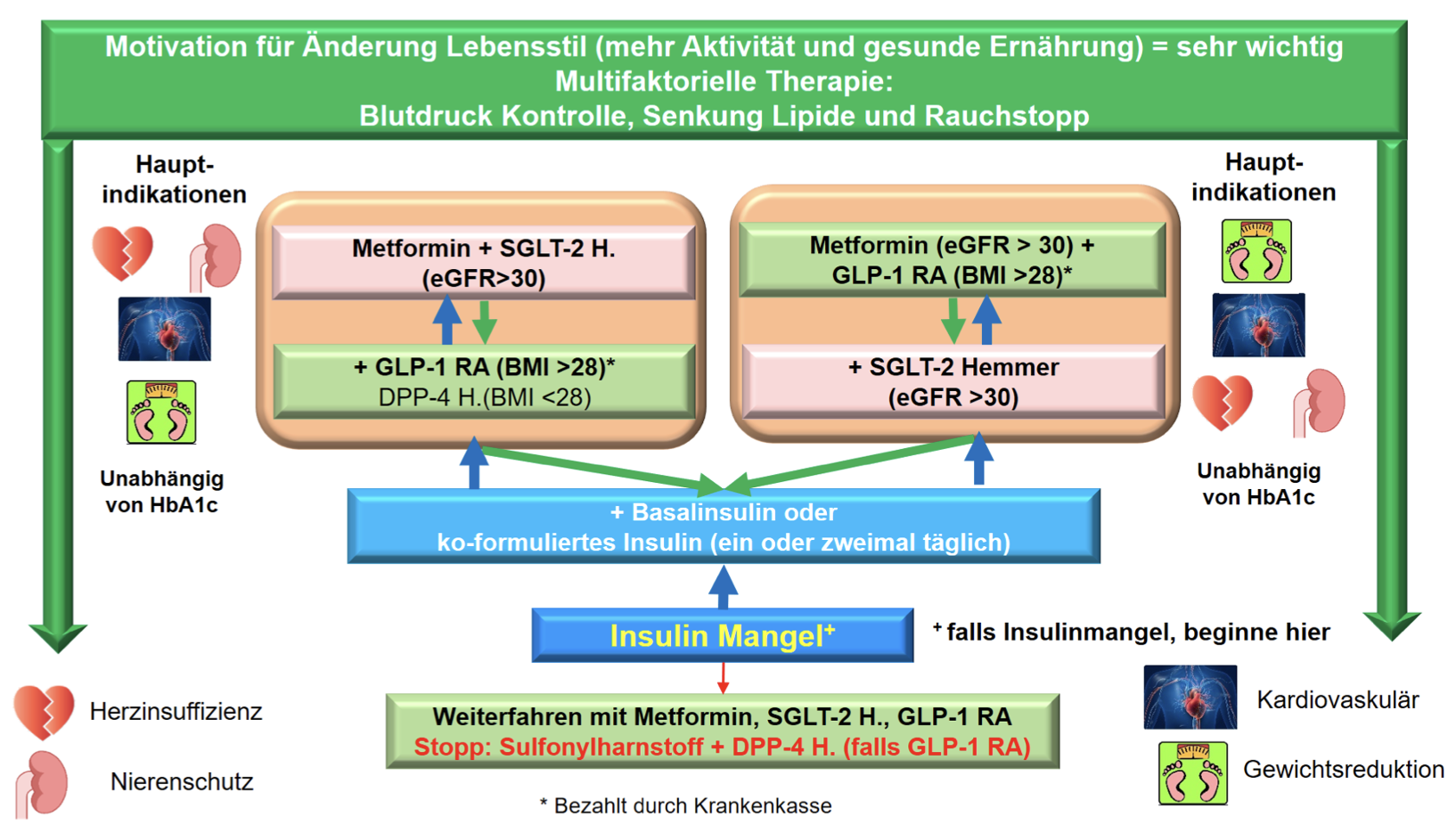
Initialtherapie
Stufe 1: Monotherapie
- Monotherapie mit Metformin
Bei Metformin-Unverträglichkeit oder -Kontraindikation werden SGLT-2-Hemmer oder GLP-1-Analoga DPP-4-Hemmer kommen bei BMI < 28 kg/m2 und KI/Unverträglichkeit von SGLT-2-Hemmer (häufige Pilzinfekte/HWI) zum Einsatz. Sulfonylharnstoffe werden wegen Exazerbation der Betazelldysfunktion, Gewichtszunahme und Hypoglykämierisiko von der SGED nicht mehr empfohlen (in resourcenärmeren Ländern werden sie weiterhin verschrieben [hohe Effektivität, geringe Kosten]) - Bei Patienten mit hohem HbA1c (≥ 8,5–9,0 %) wird von Beginn an eine Zweierkombination und bei Zeichen eines Insulinmangels (Gewichtsverlust, schlechter Allgemeinzustand) eine Insulintherapie empfohlen (siehe Tabelle 2).
Stufe 2: Zweierkombination
Wenn die BZ-Ziele mit der Stufe 1 nicht erreicht werden (nach 3–6 Monaten)
- Zusätzlich zu Metformin ein zweites Antidiabetikum. Bevorzugt werden GLP-1-Analoga oder SGLT-2-Hemmer
- Ein GLP-1-Agonist wird bevorzugt, wenn eine Gewichtsabnahme ein primäres Anliegen ist und der BMI > 28 kg/m2 ist (hilfreich bei Patienten mit fehlendem Sättigungsgefühl/grossen Mahlzeitenportionen)
- Ein SGLT-2-Hemmer wird bevorzugt bei Herz- und Niereninsuffizienz
- DPP-4 Hemmer, wenn BMI < 28 kg/m2 und NW auf SGLT-2 Hemmer
- Alternative Basisinsulin: Je höher das HbA1c, desto effektiver sollte die Therapie sein. Bei HbA1c > 8,5 % ist Insulin immer eine gute Indikation.
Stufe 3: Dreierkombination
Wenn die BZ-Ziele mit der Zweierkombination nicht erreicht werden (nach 3–6 Monaten)
- Einleitung einer Tripeltherapie: Bevorzugt wird Kombination aus Metformin, SGLT-2 Hemmer und GLP-1 Agonist. Aus Kostengründen verlangt die Krankenkasse (noch) eine KoGu zur Kombination von SGLT-2-Hemmer und GLP-1 Agonisten.
Begründung für Zugabe SGLT-2-Hemmer: Chronische Nieren- oder Herzinsuffizienz (z. B. Nachweis reduzierte GFR, Mikroalbuminurie, eingeschränkte EF).
Begründung für Zugabe GLP-1 Agonist: BMI > 28 kg/m2. - Werden die Bedingungen für eine Kombination von GLP-1 Agonist und SGLT-2 Hemmer nicht erfüllt, alternativ zu Metformin und SGLT-2 ein DPP-4-Hemmer und zu Metformin und GLP-1 ein Basisinsulin.
Stufe 4: Insulintherapie
Wenn die BZ-Ziele mit einer Dreierkombination nicht erreicht werden (nach 3–6 Monaten)
Insulin hinzugeben oder ausbauen! Kein weiteres OAD!
- Basisinsulin (1 x tägliche Injektion)
- Ko-formuliertes Insulin = Mischinsulin = Ryzodeg (2 x tägliche Injektion)
- Basis Bolus Insulin (4 x tägliche Injektionen)
Wahl der Anzahl Injektionen je nach Höhe des HbA1c bzw. Grad der Entgleisung. Ziel der Diabetologie ist es, Basis Bolus zu vermeiden. Bei steigendem HbA1c (HbA1c > 8,5%) frühzeitig Basisinsulin erwägen, womit der Diabetes häufig über längere Zeit stabilisiert werden kann.
3.3.1. Orale Antidiabetika (OAD)/Nicht-Insulin-Antidiabetika
1. Metformin (Glucophage® und Generika)
- Verbessert die Insulinresistenz, hemmt die hepatische Glukoneogenese. Orales Antidiabetikum mit der besten Datenlage, gewichtsneutral, keine Hypoglykämien
- Dosierung: Wegen gastrointestinaler NW (Durchfall) einschleichend: 500 mg vor dem Abendessen und alle 4–5 Tage um 500 mg erhöhen. Übliche Erhaltungs- und Zieldosis: 2 x 1 g. Über 2 g/d bringt selten eine Verbesserung
- Dosisanpassung: Bei Niereninsuffizienz mit Kreatinin-Clearance < 30 ml/min Metformin absetzen, bei Clearance 30–45 ml/min Dosisreduktion (Halbierung) und regelmässige Kontrolle der Nierenfunktion (alle 3 Monate) (30).
Beachte: Patienten informieren, bei Durchfall, verminderter Flüssigkeitsaufnahme, Erbrechen oder Fieber Metformin zu pausieren (Laktatazidose) - Hinweis: Die Langzeittherapie mit Metformin kann einen Vitamin-B12-Mangel (wegen beeinträchtigter Absorption) verursachen (Cave: Fehlinterpretation diab. Neuropathie!). Gelegentliche Kontrollen des Vitamin-B12-Spiegels (–> mediX GL Vitamin B12-Mangel) können sinnvoll sein (11, 31).
2. SGLT-2-Hemmer
- Dapagliflozin (Forxiga®), Canagliflozin (Invokana®, Vokanamet®), Empagliflozin (Jardiance®, Jardiance Met®) und Ertugliflozin (Steglatro) hemmen die Rückresorption der Glukose und erhöhen die Glukoseausscheidung mit dem Harn.
Dosierungen: Dapagliflozin 5–10 mg, Empagliflazon 10 mg (Dosiserhöhung auf 25 mg bringt keinen BZ-Vorteil, aber vermehrt NW) - Bei Diabetikern mit atherosklerotischer kardiovaskulärer Erkrankung Reduktion von Herzinsuffizienz, kardialer und Gesamtsterblichkeit. Nephroprotektive Effekte mit verlängerter Lebenserwartung bei Pat. mit chronischer Niereninsuffizienz (auch ohne Diabetes) (48)
- Bei Diabetikern ohne kardiovaskuläre oder Nierenerkrankung
- Vorteile: Gewichtsverlust (ca. 5 kg), geringe Blutdrucksenkung (ca. 4/2 mmHg)
- Indikation: Gut geeignet bei Patienten mit KHK, insbesondere bei Herzinsuffizienz
- Niereninsuffizienz: Unter einer GFR von 15 ml/min hat nur Canagliflozin eine Indikation, darüber sind alle SGLT-2 Hemmer einsetzbar
- Nebenwirkungen/Nachteile
- Harnwegsinfektionen leicht und Genitalinfektionsrisiko (Pilz) deutlich erhöht (um
die 10 %), vor allem bei Frauen - Cave: Normoglykämische Ketoazidose wurde unter SGLT-2 Hemmern bei Typ-1-Diabetes beobachtet (–> Gabe bei Typ-1-Diabetes nur durch Diabetologen). Bei Typ-2-Diabetes pausieren bei Durchfall, verminderter Flüssigkeitsaufnahme, Erbrechen, Fieber.
- Harnwegsinfektionen leicht und Genitalinfektionsrisiko (Pilz) deutlich erhöht (um
-
3. GLP-1-Rezeptoragonisten
Inhaltsstoff
Markenname
Injektionsintervall
Verfügbarkeit
Semaglutid
Ozempic
Wöchentlich s.c.
Kontingentiert, keine Neuverschreibungen
Rybelsus
Täglich p.o.
Uneingeschränkt
Dulaglutid
Trulicity
Wöchentlich s.c.
Kontingentiert, keine Neuverschreibungen
Tirzepatid
Mounjaro
Wöchentlich s.c.
Demnächst gelistet
- Darüber hinaus gibt es in Kombination mit Insulin: Xultophy (liraglutid + degludec Insulin [Tresiba®]), Suliqua (lixisenatid + glargin Insulin [Lantus®]). Je nach Patientenpräferenz können Basisinsulin und GLP-1 Agonist in diesen Präparaten kombiniert werden
- Für Adipositas: Saxenda® (Semaglutid für Jugendliche bis 18 J) und Wegovy® (Semaglutid für Erwachsene)
Limitatio für Wegovy®
Nur als Ergänzung zu einer 500 kcal/Tag-Defizit-Diät, begleitender Ernährungsberatung und verstärkter, belegter (z. B. Schrittzähler) körperlicher Aktivität bei motivierten Patienten (ohne vorangegangene bariatrische Operation und ohne geplante oder bevorstehende bariatrische Operation) zur Gewichtsregulierung bei erwachsenen Patienten mit
- BMI ≥ 35 kg/m2
- BMI ≥ 28kg/m2, falls zusätzliche gewichtsbedingte Begleiterkrankungen (Prädiabetes oder Typ-2 Diabetes melitus, arterielle Hypertonie, Dyslipidämie vorliegen. -
Aufgrund weltweiter Nachfrage werden s.c. GLP-1 Agonisten (Ozempic und Trulicity) kontingentiert. Daher keine Neuverschreibungen von s.c. GLP-1 Agonisten, sondern Neueinstellungen mit Rybelsus. Nichtsdestotrotz müssen auch langjährige Patienten mit s.c. GLP-1 Agonisten auf Rybelsus umstellen. Dosierungen: 0,25 mg Ozempic = 3 mg Rybelsus, 0,5 mg Ozempic = 7 mg Rybelsus und 1 mg Ozempic = 14 mg Rybelsus – je nach Ansprechen und Verträglichkeit Dosis anpassen.
Wichtig: Einnahme zur Gewährleistung einer optimalen Resorption nüchtern mind. 30 Minuten vor jeglichen anderen Medikamenten, am besten morgens zwischen 4–6 Uhr beim morgendlichen WC-Gang - Tirzepatid (Mounjaro®) ist ein neu zugelassener GIP*-/GLP-1-Rezeptoragonist, der sich insbesondere durch eine deutlich stärkere Reduktion des Körpergewichts auszeichnet (51), zudem ist die blutzuckersenkende Wirkung ausgeprägter (52).
Aufgrund fehlender Langzeiterfahrungen (und der hohen Kosten) ist Tirzepatid zunächst als Reservemedikament Eine Umstellung auf Tirzepatid kann erwogen werden, wenn keine ausreichende BZ-Einstellung unter ausdosiertem Semaglutid/dulaglutid erzielt werden kann.
* GIP= Glucoseabhängiges insulinotropes Peptid
Beachte: GLP-1-Rezeptoragonisten und DPP-4-Hemmer (s. u.) nicht kombinieren, weil sie das gleiche Wirkprinzip haben!- Vorteile: Keine Hypoglykämie, Gewichtsabnahme (z. T. signifikant), kardio- und nephroprotektiv (44)
- Indikation: Besonders geeignet bei Patienten mit Adipositas (BMI muss > 28 kg/m2 sein) die unter ihrem Gewicht leiden und die ein erhöhtes kv Risiko haben; bei Typ-1-Diabetikern off label erlaubt (wenn Gewichtsprobleme vorhanden sind), z. T. werden die Kosten von den KK nach Gutsprachegesuch übernommen
- Niereninsuffizienz: Studien zeigen sicheren Einsatz bis zur Dialyse, somit unproblematisch bei eingeschränkter Nierenfunktion (siehe Schema oben)
- Nebenwirkungen/Risiken: Zu Beginn bis zu 30 % gastrointestinale Beschwerden (Nausea), leicht erhöhtes Risiko für Gallensteine und andere Gallenblasenerkrankungen (47).
Beachte: Bei Patienten mit diabetischer Retinopathie (DR) sollte vor Therapieaufnahme eine augenärztliche Untersuchung erfolgen (und anschliessend Kontrollen), da sich eine DR unter der Therapie mit GLP-1-Agonisten verschlechtern kann (50). - Nachteile: S.c. Injektion 1 x/Woche, hohe Kosten.
4. DPP-4-Hemmer (Gliptine)
- Gliptine hemmen die Dipeptidylpeptidase, welche u. a. das Inkretin GLP-1 inaktiviert, das im Anschluss an die Nahrungsaufnahme ausgeschüttet wird und die Insulinsekretion in Abhängigkeit vom BZ fördert. Bei normalem BZ findet keine Stimulation der Insulinsekretion statt.
Beachte: DPP-4-Hemmer und GLP-1-Rezeptoragonisten nicht kombinieren, weil sie das gleiche Wirkprinzip haben! - Medikamente: Sitagliptin (Januvia®), Vildagliptin (Galvus®), Linagliptin (Trajenta®), Saxagliptin (Onglyza®)
- Vorteile: Kaum NW. Gliptine können oral eingenommen werden, führen nicht zu Hypoglykämien und sind gewichtsneutral. Sie können bei Niereninsuffizienz angewendet werden mit Dosisanpassung (bei Linagliptin keine Anpassung notwendig)
- Indikation: Gut geeignet bei Patienten mit Niereninsuffizienz, Übergewicht/Adipositas und bei denen Hypoglykämien vermieden werden sollten
- Kontraindikationen: Hepatopathie (bei Vildagliptin)
- Nachteile: Geringere HbA1c-Senkung als mit GLP-1 Agonisten, daher GLP-1 Agonisten bevorzugt. Keine positiven Effekte auf kardiovaskuläre Ereignisse in Endpunktstudien.
5. Sulfonylharnstoffe (SH)
- Stimulation der Beta-Zellen. Die Wirksamkeit der Sulfonylharnstoffe lässt in der Regel im Behandlungsverlauf nach. Sie sind deshalb zur Langzeit-Monotherapie des Typ-2-Diabetes nur bedingt geeignet, sind aber meistens gut wirksam in den ersten Jahren. In den überarbeiteten SGED-Richtlinien 2023 werden sie nicht mehr empfohlen, in den ADA-Richtlinien 2024 weiterhin, da sie eine effektive und billige Therapie darstellen
- Gliclazid (Diamicron® und Generikum Gliclazid): einziger einzusetzender Sulfonylharnstoff. Es gibt Hinweise aus Endpunktstudien auf günstige mikrovaskuläre Effekte; auch bei Niereninsuffizienz bis GFR > 30 ml/min anwendbar. Das Hypoglykämierisiko ist gering
- Dosierung: Die Anfangsdosis beträgt 30–60 mg/d, 1 x tgl. als Retardpräparat. Die Erhaltungsdosis 1–3 Tabletten pro Tag (4), die auf einmal (morgens!) eingenommen werden. Maximale Tagesdosis: 120 mg
- Nebenwirkungen: V. a. Hypoglykämien und Gewichtszunahme
- Nicht empfohlen werden
- Glibenclamid (Daonil®, Euglucon®, Generika) (13)
- Glimepirid (Amaryl® und Generika).
6. Glinide
- Repaglinid (NovoNorm®). Wirkprinzip ähnlich wie bei Sulfonylharnstoffen (SH), aber schnellerer Wirkungseintritt, kürzere Wirkdauer als SH
- Einnahme-Prinzip: Time to eat, time to treat
- Indikation: Bei Patienten mit schwerer Niereninsuffizienz aufgrund der kurzen Halbwertszeit; Glinide sollten nur in seltenen Fällen vom Diabetologen verschrieben werden. In den überarbeiteten SGED-Richtlinien 2023 werden sie nicht mehr empfohlen
- Nebenwirkungen: Hypoglykämien
- Nachteile: Einnahme zu jeder Mahlzeit, daher schlechte Compliance.
3.3.2. Insulintherapie (3, 6, 8, 18, 19)
Indikation
- Bevorzugtes add on zu Metformin, SGLT2 und GLP-1
- Bei Symptomen eines Insulinmangels (Gewichtsverlust, schlechter Allgemeinzustand)
- HbA1c > 8.5 %: Beginn mit Basisinsulin erwägen, > 9 % empfohlen
- Bei Schwangeren (egal ob vorbestehend oder Gestationsdiabetes).
Generell
- Kurze Nadeln verschreiben (4–6 mm)
- Alle Insuline kommen in 5-er Packungen. Cave bei der Verschreibung: Fertigpens
(= Flextouch, Solostar) sind die Regel, verglichen mit Ampullen (Penfill) für Patienten mit Metallpens.
Insulin-Therapieschemata
Basisinsuline
- Bei ungenügend kontrolliertem Diabetes unter Tripeltherapie Zugabe eines einmal täglich gespritzten Langzeitinsulins
- Einstieg meistens mit Levemir® oder Lantus® oder Abasaglar®, alternativ auch die teureren Basisinsuline Tresiba® oder Toujeo®
- Dosierung: Beginn mit 10 E (bei übergewichtigen Patienten auch mehr erlaubt) einmal täglich, Steigerung alle 2 Tage um 2 E, bis Nüchtern-BZ < 8 mmol/l, idealerweise 6–7 mmol/l.
Cave: Eine Basisinsulin-Dosis von ca. 1/3 des Körpergewichtes nicht weiter steigern! In diesem Fall ist Zugabe eines Bolusinsulins notwendig (entweder als Mischinsulin oder als Basis Bolus Schema). Hohe Dosen Basisinsulin vermögen den BZ tagsüber nicht ausreichend zu senken, führen nur zu weiterer Gewichtszunahme.
- Dosierung: Beginn mit 10 E (bei übergewichtigen Patienten auch mehr erlaubt) einmal täglich, Steigerung alle 2 Tage um 2 E, bis Nüchtern-BZ < 8 mmol/l, idealerweise 6–7 mmol/l.
Hinweise
- Die ultralang wirksamen Tresiba® oder Toujeo® können verordnet werden, wenn trotz ausdosiertem Levemir/Lantus/Abasaglar® morgendliche Hyperglykämien auftreten bzw. der BZ über Nacht ansteigt oder wenn der Patient Spitex benötigt (Insulininjektion vor der Bettruhe nicht möglich), da Tresiba® und Toujeo® jederzeit gespritzt werden können (zeitunabhängig aufgrund der langen Halbwertszeit)
- Insulatard® ist instabil und wird ausserhalb der Schwangerschaft kaum mehr eingesetzt.
Mischinsuline = ko-formulierte Insuline
- Bei weiterhin ungenügend kontrolliertem Diabetes mit ausdosiertem Basisinsulin muss Bolusinsulin dazugegeben werden, am einfachsten zweimal täglich als ko-formuliertes Insulin
- Bedingungen: Sehr regelmässiger Tagesablauf mit regelmässigen, relativ konstant zusammengesetzten Mahlzeiten, konkret bei betagten Patienten oder Alters-/Pflegeheimbewohnern. Wegen der mangelnden Flexibilität nicht bei jüngeren Patienten einsetzen!
- Dosierung: Injektion vor den 2 Hauptmahlzeiten. Morgendosis: Deckt Frühstück und Mittagessen ab, wird anhand des BZ vor dem Abendessen angepasst. Abenddosis: Deckt Abendessen und Nacht ab, wird anhand des Nüchtern-BZ angepasst. Isst der Patient vor allem mittags ein Menü, kann mittags und abends oder morgens und mittags gespritzt werden
- Wichtigster Vertreter = Ryzodeg® enthält Insulin aspartat (30 %) und Insulin degludec
(70 %). Beispiel: 15 E Ryzodeg = 5 E Insulin aspartat und 10 E Insulin degludec. Selten verwendet wird Humalog Mix (Humalog in Kombination mit (instabilem) Insulatard) - Dosierung anhand der Mahlzeitengrösse, z. B. mit 12 E vor dem Frühstück und 10 E vor dem Abendessen, Dosis steigern anhand des gemessenen BZ in 4 E-Schritten
- Während der Dosisfindung wird ein Blutzuckertagesprofil erstellt (Blutzuckermessung vor Frühstück, Mittag- und Abendessen), sobald die geeignete Dosis gefunden wird kann die Messfrequenz reduziert werden (z. B. einmal alle 10 Tage oder nur HbA1c).
Basis-Bolus-Therapie
- Besteht aus schnell wirksamem Insulin zu den Hauptmahlzeiten und Basisinsulin (4 x tägliche Injektionen)
- Höchste Flexibiltät, aber auch höchste Komplexität
- Vorbestehende Therapie (Metformin, GLP-1 Agonist, SGLT-2 Hemmer) wird belassen
- Aufgrund häufiger Blutzuckermessungen wird immer ein CGMS angeboten (Freestyle libre oder Dexcom, s. u.)
- Indikation: Bei Typ-2-Diabetes, wenn Therapieziele nicht anders erreicht werden können
- Nachteil: Höchstes Hypoglykämierisiko.
⇒ Bolus-Insuline: Insulin aspartat (Novorapid®, Fiasp®) Insulin lispro (Humalog®, Lyumjev®), Insulin glulisin (Apidra®)
- Wirkdauer: 2–5 h. Alle Insuline haben eine ähnliche Wirkkurve und sind gleich gut
- Fiasp® und Ljumjev® sind ultraschnellwirksam, jeweils ca 5 Minuten schneller im Anfluten als Novorapid® bzw Humalog®. Gelegentlich bei Typ-1-Diabetikern verschrieben, bei denen ein 15 minutiger Spritz-Ess-Abstand wichtig ist.
⇒ Basisinsuline
- 2. Generation-Basalinsuline = Wirkdauer 24 h, sind Detemir (Levemir®), Glargin (Lantus®, Abasaglar®)
- Alle sind gleich gut, nur die Firma ist jeweils eine andere (NovoNordisk vs Sanofi)
- 3. Generation-Basalinsuline = ultralang wirksam, ca. 48 h, sind Tresiba® und Toujeo®
- Sehr stabil, weniger Hypoglykämien.
|
Insulin-Dosierungen |
|
Bei Typ-2-Diabetes Bei Erstverschreibung wird empfohlen
Bei Typ-1-Diabetes Zuweisung an Diabetologen (Erlernen Abwiegen von KH, Insulinpumpe) |
CGMS = continuous glucose measuring devices
- Werden allen Patienten mit 4 x täglicher Insulininjektion (Basis Bolus Schema) angeboten und von KK vergütet (bei selteneren Injektionen Bezug als Selbstzahler möglich)
- Vorteile
- Anwender sieht nicht nur den aktuellen Blutzucker, sondern einen Trendpfeil (steigend, sinkend, stabil) welcher beim Handlungsentscheid hilfreich ist (z. B. hoher Blutzucker mit sinkendem Trendpfeil wird u. U. beobachtet und nicht korrigiert, normaler Blutzucker mit steigendem Trendpfeil wird u. U. korrigiert)
- Keine schmerzhaften kapillären Messungen, letztere nur bei vermuteter Fehlanzeige des CGMS notwendig (z. B. tiefer gemeldeter BZ ohne Hypoglykämiesymptome).
- Nachteile
- Timelag: CGMS misst Glukose subkutan nicht kapillär, daher hinkt diese hinter der tatsächlichen Blutglukose hinterher: Im Alltag überwiegen die Vorteile bzgl. Komfort und Trendpfeil diesen Nachteil
⇒ Folgende CGMS sind erhältlich
- Freestyle libre
- Freestyle libre 2: Mit Alarmfunktion zur Warnung vor Hypo- und Hyperglykämie
- Freestyle libre 3: Wie 2, zudem kleiner und real time-Übertragung auf Natel (kein scannen nötig)
- Dexcom G7: Gleiche Funktionen wie Freestyle libre 3, ähnliche Form und Grösse.
3.3.3. Notfalltherapie bei Hypoglykämie
- Baqsimi® ist ein Glukagon in der Form eines Nasensprays, der bei bewusstlosen Patienten verabreicht werden kann. Es handelt sich um eine Einmalgabe per Pumpstoss und ersetzt das bisherige GLUCAGEN Novo Hypo-Kit, das zuerst gemischt und anschliessend i.m. verabreicht werden musste (einfachere Abgabeart)
- Vorgehen: siehe mediX Notfälle in der Praxis: Hypoglykämie.
3.4. Kontrolle und Therapie von Begleiterkrankungen
1. Blutdrucksenkung
- Antihypertensiva der 1. Wahl
- ACE-Hemmer oder AT-II-Blocker; niedrig dosierte Diuretika (Thiazide, Chlorthalidon) (24) können dazu gegeben werden, danach Calciumantagonisten, Schleifendiuretika, Alpha-Blocker
- Betablocker sollen nur bei kardialer Indikation eingesetzt werden.
- Blutdruckziele
- Bei Patienten bis 65 Jahre soll ein BD-Ziel ≤ 130/80 mmHg angestrebt werden, wenn die antihypertensive Therapie vertragen wird; jedoch nicht < 120 mmHg systolisch
- Bei Patienten über 65 Jahre soll ein BD-Ziel von ≤ 140/80 mmHg angestrebt werden, wenn die Therapie vertragen wird. Bei gebrechlichen und/oder hochbetagten Patienten müssen die BD-Ziele ggfls. angepasst werden (≤ 150/90 mmHg).
Weitere Informationen zur antihypertensiven Therapie –> mediX GL Hypertonie - Hinweis: Diabetiker ohne erhöhten BD aber mit Mikroalbuminurie sollen ebenfalls ACE-Hemmer bekommen (Nephroprotektion).
2. Lipidsenkende Therapie
- mediX empfiehlt auch bei Diabetikern grundsätzlich eine Statin-Therapie in fixer Dosierung („fire and forget“-Strategie)
- Wird alternativ die treat-to-target-Strategie gewählt, gelten folgende Empfehlungen
- Statine bei allen Diabetikern in der Primärprävention > 40–75 J. –> LDL-Zielwert:
< 1,8 mmol/l - Typ-2-Diabetiker mit Endorganschäden oder mindestens drei weiteren kv Risikofaktoren gehören zur Hochrisikogruppe. Bei ihnen soll ein LDL-Zielwert < 1,4 mmol/l angestrebt werden. Das gilt auch für Typ-1-Diabetiker, sofern bereits Endorganschäden aufgetreten sind (35)
- Statine bei allen Diabetikern in der Primärprävention > 40–75 J. –> LDL-Zielwert:
⇒ Weitere Informationen zur Therapie des Hyperlipidämie, zu den LDL-Zielwerten und deren kritische Bewertung siehe mediX GL Hyperlipidämie
3. Aspirin (ASS)
- Die primärpräventive Gabe wird nicht mehr empfohlen (3, 22, 23, 46)
- ASS wird von der SGED (3) nur empfohlen zur Sekundärprävention bei etablierter kardiovaskulärer Krankheit.
mediX empfiehlt keine generelle Aspiringabe bei Diabetikern. Bei Hochrisikopatienten und nach klinischer Beurteilung kann ASS erwogen werden.
Kontrolluntersuchungen zur Verminderung von Komplikationen
1. Diabetische Retinopathie
- Typ-1-Diabetes: 1–2-jährliche Augenkontrolle (1. Mal spätestens nach 5 Jahren)
- Typ-2-Diabetes: 1. Mal bei Diagnosestellung, bei fehlender Retinopathie alle zwei Jahre, bei Retinopathie mind. jährlich oder auf augenärztliche Empfehlung
- Bei beiden Formen: Sofortige Kontrolle bei Visusverschlechterung (bei starken BZ-Schwankungen handelt es sich meistens um vorübergehende Akkomodationsstörungen: Osmosewirkung. Keine Brille anpassen!)
- Gute BD- und BZ-Kontrolle anstreben.
- Vorlage Augenärztliche Kontrollen
2. Diabetische Nephropathie (3, 25)
- Mikroalbuminurie gilt als erstes Zeichen der Nephropathie
- Abklärung: Albumin-Kreatinin-Ratio eines Spontanurins in der Praxis: Eine Mikroalbuminurie liegt bei > 30 mg/g bei 2 von 3 Tests in 4–6 Monaten vor.
Beachte: Falsch erhöhte Albuminausscheidung bei körperlicher Aktivität, Infekt, Fieber, Herzinsuffizienz, längerdauernder deutlicher Hyperglykämie, Menstruation, unkontrollierter Hypertonie. - Alle Patienten mit einer Mikroalbuminurie sollten einen ACE-Hemmer oder AT-II-Blocker einnehmen
- SGLT-2 Hemmer erwägen
- Gute Kontrolle des Diabetes und Blutdruckes anstreben
- Urinuntersuchung: mediX empfiehlt beim asymptomatischen Patienten keine routinemässige Urinuntersuchung auf HWI. Ein asymptomatischer HWI muss auch bei Diabetes nicht behandelt werden.
Screening auf Mikroalbuminurie
- Typ-1-Diabetes: Jährlich (1. Mal spätestens nach 5 Jahren)
- Typ-2-Diabetes: Jährlich (1. Mal bei Diagnosestellung)
Hinweis: Bei bekannter Mikroalbuminurie ist jährliche Kontrolle auf Proteinurie angezeigt.
Mögliche Alternative: Gerechtfertigt scheint auch ein Screening ausschliesslich bei Patienten mit weiteren kardiovaskulären und renalen Risikofaktoren, sofern diese bei Kenntnis einer Mikroalbuminurie zu einer strengeren Kontrolle von Risikofaktoren bereit wären.
3. Diabetische Neuropathie (28)
- Die diabetische Polyneuropathie ist heterogen und hat diverse klinische Erscheinungsformen (kann auch fokal, asymmetrisch sein). Die häufigste ist die distale symmetrische Polyneuropathie. Es sollte aber auch nach Symptomen einer autonomen Polyneuropathie (Ruhetachykardie, Leistungsintoleranz, orthostatische Hypotension, Verstopfung, Gastroparese, erektile Dysfunktion) gesucht werden
- Meistens ist die diabetische Polyneuropathie eine Ausschlussdiagnose und benötigt keine speziellen Untersuchungen.
Hinweis: Bei schwerer Polyneuropathie auch an andere Ursachen denken und diese ausschliessen (z. B. Vitamin-B12-Mangel, HIV, Hypothyreose, Alkohol-Anamnese, Niereninsuffizienz).
Neurologische Untersuchung
- Oberflächensensibilität: Monofilament Plantarseite Metatarsale 1–2, plantar distal an der Grosszehe (nie an verhornten Stellen). Monofilament ist auch im Alter verlässlich
- Tiefensensibilität: Reflexe (ASR, PSR), Lagesinn, Vibration (Norm ≥ 5/7, pathologisch ≤ 4/8) am Strahl I Grundgelenk medial.
Hinweis: Auch bei Gesunden über 70-Jährigen können der ASR und der Vibrationssinn bimalleolär fehlen.
–> Überweisung zum Neurologen, wenn- Motorische statt sensible Ausfälle dominieren
- Die Symptomatik sich rasch entwickelt oder fortschreitet (trotz guter Stoffwechsellage)
- Die Symptomatik an den oberen Extremitäten beginnt.
Beachte: Nicht jede mit Diabetes mellitus assoziierte Polyneuropathie ist eine diabetische Polyneuropathie.
4. Fusskontrolle
- Kontrolle 1 x/Jahr, bei schlecht eingestellten Diabetikern häufiger. Bei jeder Konsultation nach den Füssen fragen
- Achten auf
- Haut: Farbe, Turgor, Rhagaden, Blasenbildung, Schwielen, subkutane Einblutungen
- Schuhe: Genug breit, flach?
- Pulsstatus?
- Hyperkeratosen und Kallusbildung
- Abgeheilte Fussläsionen, Hypo- bzw. Anhidrose
- Zeichen einer bakteriellen Infektion und/oder Mykose
- Fussdeformitäten (z. B. Charcot-Arthropathie, Hammerzehen, Krallenzehen)
- Fussulkus mit Angabe von Lokalisation, Ausdehnung und Begleitinfektion.
- Massnahmen
- Füsse täglich waschen, duschen, Fussbad wegen Aufweichung eher nicht empfohlen, Wassertemperatur nicht über 30 Grad, Füsse immer gut trocknen (keinen Föhn benutzen) und eincremen mit neutraler Creme (Mandelöl, Allpresan Schaum, Dexeryl etc.)
- Immer zuerst die Schuhe ausschütteln (Fremdkörper beseitigen)
- Bei Schuppung (Hyperkeratose ist ein Hauptzeichen der diabetischen Neuropathie: Der Patient schwitzt nicht mehr) z. B. Excipial® 10 % Urea (keine salicylathaltigen Salben oder Allpresan® Fussschaum)
- Nägel nur mit Kartonfeilen kürzen oder Maniquick (geeignetes Schleifgerät)
- Mykosen konsequent behandeln. Ausnahme Nagelmykose –> siehe mediX GL Onychomykose
- Patienten sollen alle 3 Monate zur medizinischen Podologin gehen, weil 70 % der Patienten ihre Füsse wegen Visusverschlechterung nicht beurteilen können
Hinweis: Podologie wird in der Grundversicherung bezahlt, wenn ein Ulcus oder eine Polyneuropathie vorhanden ist. Sonst nur von der Zusatzversicherung.
-
Bei Fehlstellungen, Schwielen, Druckstellen frühzeitig mit Einlagen behandeln.
-
Behandlung der distalen Polyneuropathie
-
Diabetes gut einstellen, Indikation zur Insulintherapie
-
Oberflächliche Schmerzen: Lokale Therapie mit Capsaicin 0,075 % 4 x tgl. Capsaicin-Salbe (0,025–0,1 %), Schmerzlinderung bei Polyneuropathie nachgewiesen (28), jedoch Gefahr irreversibler Nebenwirkungen (z. B. Sensibilitätsstörungen) (3, 26).
mediX empfiehlt diese Substanz bei Diabetikern nicht! - Tiefer Schmerz: Antiepileptika (38, 39) wie Gabapentin (z. B. Neurontin®, Generika)
900–3’400 mg (auftitrieren) (27), Pregabalin (Lyrica®), Duloxetin (Cymbalta®). Sind alle etwa gleich wirksam und sollten gemäss Nebenwirkungsprofil und Co-Morbidität gewählt werden.
Reservemedikamente: Trizyklische Antidepressiva, wie Imipramin (Tofranil®) 25–75 mg, Amitriptylin (Saroten®) 25–75 mg, Clomipramin (Anafranil®) 25–150 mg. - Ev. Therapieversuch mit Dafalgan® abends.
-
- Achten auf
Kardiologische Kontrolle
- Nur bei anamnestischen Hinweisen für kardiale Symptome, nicht routinemässig.
3.5. Diabetes und Autofahren
- Für eine Erstzulassung oder Weiterbelassung als Motorfahrzeuglenker müssen bei Diabetikern folgende Bedingungen erfüllt sein
- Keine verkehrsrelevanten diabetischen Spätfolgen vorhanden (z. B. ungenügende Sehschärfe, Gesichtsfeldeinschränkungen, Neuropathie oder Herz-Kreislauferkrankungen, welche die Fahrzeugbedienung beeinträchtigen)
- Keine wesentliche Hyperglykämie, insbesondere keine mit Allgemeinsymptomen einhergehende BZ-Erhöhung mit Auswirkungen auf die Fahrfähigkeit
- Zudem ist das individuelle Hypoglykämierisiko zu bestimmen, in Abhängigkeit von der gewählten Therapieart und der Hypoglykämiewahrnehmung (s. Tabelle 3).
Tabelle 3: Hypoglykämierisiko und Massnahmen bei Lenkern der 3. medizinischen Gruppe (nach [40])

Ausführliche Informationen finden sich in den SGED-Richtlinien
SGED: Richtlinien bezüglich Fahreignung und Fahrfähigkeit bei Diabetes mellitus (2017); Merkblatt für Fahrzeuglenker mit Diabetes.
3.6. Gestationsdiabetes
Diagnose
- Screening bei allen Schwangeren zwischen der 24. und 28. SSW, bei erhöhtem Risiko (familiäre Belastung mit Diabetes, St. n. Gestationsdiabetes, ethnische Herkunft, BMI > 30 kg/m2) ab der 12. SSW
- Nüchtern-BZ-Screening (8 h nüchtern): < 4,4 mmol/l (Plasma) ist ein Gestationsdiabetes ausgeschlossen
- Nüchtern-BZ ≥ 5,1 mmol/l –> Gestationsdiabetes ist gesichert (ohne OGTT!)
- Nüchtern-BZ 4,4–5,0 mmol/l –> 75 g OGTT durchführen –> bei BZ 1 h ≥ 10 mmol/l und/oder
2 h ≥ 8,5 mmol/l –> Gestationsdiabetes ist gesichert (1) - Durchführung 75 g OGTT: 8 h nüchtern, während dem Test soll die Schwangere nicht körperlich aktiv sein und nichts essen
- HbA1c-Bestimmung in SS nicht relevant, da v. a. die postprandialen BZ-Spitzen für die Entwicklung einer Makrosomie verantwortlich sind.
Therapie
- Diät reicht bei 70–80 % der Schwangeren; falls ungenügend: Bei erhöhten Nüchternblutzucker Insulatard (Levemir®/Lantus® auch möglich, aber teurer), bei erhöhten postprandialem BZ Novorapid®. Bei hohem Insulinbedarf oder Adipositas Metformin hinzugeben
Follow up
- 6–8 Wochen nach der Geburt bzw. nach dem Abstillen: Nüchtern-Plasmaglukose und/oder 75 g OGTT und/oder HbA1c.
Prognose
- Der Gestationsdiabetes verschwindet meistens nach Beendigung der Schwangerschaft (abh. von BMI und BZ-Werten). Jedoch haben die Frauen ein Risiko von 25–60 %, später einen Typ-2-Diabetes zu entwickeln. Vorgeschlagen wird, das Gewicht vor der Schwangerschaft wieder zu erreichen, ausserdem viel Bewegung.
4. Literatur
- Kerner W, Brückel J: Definition, Klassifikation und Diagnostik des Diabetes mellitus. Diabetologie 2011; 6: 107 S110.
- Bopp M, et al.: Routine Data Sources Challenge International Diabetes Federation Extrapolations of National Diabetes Prevalence in Switzerland.Diabetes Care. 2011; 34(11): 2387–2389.
- Empfehlungen der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie (SGED/SSED) für die Behandlung von Diabetes mellitus Typ 2 (2022).
- Tabák AG, et al.: Prediabetes: a high-risk state for diabetes development. Lancet 2012; 379: 2279–2290.
- Schweizerische Gesellschaft für Endokrinologie und Diabetologie: Messung des HbA1c zur Diagnose des Diabetes mellitus – Stellungnahme der SGED/SSED (2010).
- Borm K, et al.: Erste Behandlungsschritte beim neuentdeckten Diabetes mellitus Typ 2 – praktische Tipps. Schweiz Med Forum 2012;12(48):929–935.
- Management of Hyperglycemia inType2 Diabetes: A Patient-Centered Approach Position Statement of the American Diabetes Association (ADA) and the European Association the Study of Diabetes (EASD). Diabetes Care 2012; 35: 1364-79.
- Philippe J, et al.: Massnahmen zur Blutzuckerkontrolle bei Patienten mit Typ-2-Diabetes-mellitus Consensus statement der Schweizerischen Gesellschaft für Endokrinologie und der Diabetologie (SGED). Schweiz Med Forum 2009; 9(3):50-55.
- UKPDS-Folgestudie – Was folgt für die Diabetestherapie? arznei-telegramm 2009; 40:74-5.
- Duckworth W, et al.: Glucose control and vascular complications in veterans with type 2 diabetes.N Engl J Med. 2009 Jan 8;360(2):129-39.
- Vitamin-B12-Mangel unter Einnahme von Metformin. Arznei-telegramm 2012:43:29-30.
- Mamtani R, et al.: Association Between Longer Therapy With Thiazolidinediones and Risk of Bladder Cancer: A Cohort Study. NCI: Journal of the National Cancer Institute, Volume 104, Issue 18, 19 September 2012, Pages 1411–1421.
- Gangji AS, et al.: A systematic review and meta-analysis of hypoglycemia and cardiovascular events: a comparison of glyburide with other secretagogues and with insulin. Diabetes Care 30 (2007) 389-394.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen: Glinide zur Behandlung des Diabetes mellitus Typ 2. 4/2009.
- Neues orales Antidiabetikum: DPP-IV-Hemmer Sitagliptin (Januvia®). Arznei-telegramm 2007; 38: 56-7.
- Orales Antidiabetikum Vildagliptin. Arznei-telegramm 2008; 39: 66-7.
- Antidiabetikum Liraglutid (Victoza®) – Plädoyer für die Marktrücknahme. Arznei-telegramm 2012; 43: 64.
- IQWiG-Abschlussbericht: Langwirksame Insulinanaloga bei Diabetes mellitus Typ 2 (2009).
- Holman RR, Thorne KI, Farmer AJ, et al.: Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes. N Engl J Med 2007 (25. Oktober); 357: 1716-30.
- IQWiG-Bericht: Urin- und Blutzuckerselbstmessung bei Diabetes mellitus Typ 2 (2005).
- Stöckli R, Zimmerli L: Hypertonie und Diabetes. Schweiz Med Forum 2009;9(36):626-629.
- AHA: Aspirin and heart disease (aufgerufen 7/2020).
- Low-Dose Aspirin for Primary Prevention of Atherosclerotic Events in Patients With Type 2 Diabetes. A Randomized Controlled Trial. JAMA 2008;300(18):2134-2141. doi:10.1001/jama.2008.623.
- Diuretika und Diabetes mellitus. Arznei-telegramm 2008; 39: 3-4.
- Nationale Versorgungsleitlinie. Nierenerkrankungen bei Diabetes im Erwachsenenalter. 11/2011. http://www.diabetes.versorgungsleitlinien.de/.
- Mason L, et al.: Systematic review of topical capsaicin for the treatment of chronic pain. BMJ 2004;328(7446):991.
- Masche U: Antiepileptika bei neuropathischen Schmerzen. Pharma-kritik. 15/2005.
- Nationale Versorgungsleitlinie Neuropathie bei Diabetes im Erwachsenenalter. 4/2012. http://www.diabetes.versorgungsleitlinien.de/.
- McBrian K, et al.: Intensive and Standard Blood Pressure Targets in Patients With Type 2 Diabetes Mellitus Systematic Review and Meta-analysis. Arch Intern Med. 2012;172(17):1296-1303.
- Lipska KJ, et al.: Use of Metformin in the Setting of Mild-to-Moderate Renal Insufficiency. Diabetes Care 2011; 34(6): 1431–1437. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3114336/.
- deJager J, et al.: Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial. BMJ 2010 (20. Mai); 340: c2181.
- Clar C, et al.: Systematic review of SGLT2 receptor inhibitors in dual or triple therapy in type 2 diabetes. BMJ Open. 2012;2(5).
- IQWiG-Bericht: Dapagliflozin – Nutzenbewertung gemäß § 35a SGB V (2013).
- Scirica BM, et al.: Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus. N Engl J Med 2013; 369:1317-1326.
- ESC/EAS-Dyslipidämie-Guidelines. Swiss Med Forum. 2020;20(0910):140-148. https://doi.org/10.4414/smf.2020.08464.
- Petrie MC, et al.: Effect of Dapagliflozin on Worsening Heart Failure and Cardiovas-cular Death in Patients With Heart Failure With and Without Diabetes.JAMA.2020;323(14):1353–68.
- Solomon SD, et al.: DELIVER Trial Committees and Investigators.Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med. 2022;387(12):1089–98.
- Nationale Versorgungsleitlinie: Neuropathie bei Diabetes im Erwachsenenalter. 08/2011 (zuletzt geändert 01/2015).
- NICE-Guideline (CG173): Neuropathic pain in adults: pharmacological management in non-specialist settings (7/2019).
- Arbeitsgruppe SGED, SDG, SGRM: Richtlinien bezüglich Fahreignung und Fahrfähigkeit bei Diabetes mellitus (2017).
- Green JB, et al.: Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015; 373:232-242.
- Jornayvaz FR: Erstbehandlung bei Verdacht auf Diabetes mellitus. Swiss Medical Forum 2015;15(47):1097-1103.
- Marso SP, et al.: Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375:311-322.
- American Diabetes Association: Pharmalogic effects of glycemic treatment. Diabetes Care, Volume 43, Supplement 1, January 2020.
- Neal B, et al.: CANVAS Program Collaborative Group:Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017;377(7):644.
- US Preventive Services Task Force: Aspirin to prevent cardiovascular disease: preventive medication, 04/2022.
- He L, Wang J, Ping F, et al.: Association of Glucagon-Like Peptide-1 Receptor Agonist Use With Risk of Gallbladder and Biliary Diseases: A Systematic Review and Meta-analysis of Randomized Clinical Trials. JAMA Intern Med.2022;182(5):513–519.
- McMurray JJV, et al.: DAPA-CKD Trial Committees and Investigators. Effect of Dapagliflozin on Clinical Outcomes in Patients With Chronic Kidney Disease, With and Without Cardiovascular Disease. Circulation. 2021 Feb 2;143(5):438-448.
- Echouffo-Tcheugui JB, Perreault L, Ji L, Dagogo-Jack S: Diagnosis and Management of Prediabetes: A Review. 2023;329(14):1206–1216. doi:10.1001/jama.2023.4063.
- Albert SG, Wood EM, Ahir V: Glucagon-like peptide 1-receptor agonists and A1c: Good for the heart but less so for the eyes? Diabetes Metab Syndr. 2023 Jan;17(1):102696. doi: 10.1016/j.dsx.2022.102696. Epub 2022 Dec 28. PMID: 36596264.
5. Anhang
Tabelle 3: Antidiabetika in der Übersicht
|
Antidiabetikum |
Präparate (Beispiele) |
Vorteile |
Nachteile |
|
Gut validierte Erstlinienmedikamente |
|||
|
Metformin |
(Metfin®, Glucophage®) |
Gewichtsneutral |
GI-Nebenwirkungen |
|
Insulin |
|
Keine Dosisgrenze, schnell wirksam, verbessert Lipidprofil |
Monitoring, Hypoglykämie, Gewichtszunahme, Insulinanaloga teuer |
|
Sulfonylharnstoffe |
Gliclazid (Diamicron® und Glibenclamid (Daonil®, Glimepirid (Amaryl®) |
Rasch wirksam, nur Gliclazid einsetzen! |
Gewichtszunahme, Hypoglykämie (insb. Glibenclamid)
|
|
Gut validierte Medikamente (vorwiegend) zur Kombinationstherapie |
|||
|
GLP-1-Agonist |
Liraglutid (Victoza®) Dulaglutid (Trulicity®) Semaglutid (Ozempic) Lixisenatid (Lyxumia) |
Gewichtsabnahme, kardio- (und nephroprotektiv) |
Injektion, |
|
SGTL-2-Hemmer |
Dapagliflozin (Forxiga®) Canagliflozin (Invokana®, Vokanamet®) |
Gewichtsabnahme, |
Genitalinfektionsrisiko deutlich erhöht (ca. 10 %), vor allem bei Frauen
|
|
Gliptine (DPP-IV-Hemmer) (auch mit Metformin kombiniert) |
Saxagliptin (Onglyza®, Sitagliptin (Januvia®, Vildagliptin (Galvus®, Linagliptin (Trajenta®, Alogliptin(Vipidia®, |
Gewichtsneutral |
Teuer, kardiovaskulär neutral; Nierenadaption notwendig (ausser Linagliptin), Kontrolle der Leberwerte bei Vitagliptin
|
|
Nicht empfohlene Antidiabetika |
|||
|
Alpha- Glucosidasehemmer |
Acarbose (Glucobay®) |
Gewichtsneutral |
GI-Nebenwirkungen, 3 x/Tag-Dosierung, teuer |
|
Pioglitazon |
Actos® |
Verbessert Lipidprofil |
Flüssigkeitsretention, Gewichtszunahme, Frakturrisiko, Blasentumor (?), teuer |
|
Glinide |
Repaglinid (NovoNorm®und Generika) Nateglinid (Starlix®) |
Bei Niereninsuffizienz wegen kurzer HWZ |
Mehrmals tägliche Dosierung, Gewichtszunahme, Hypoglykämie, teuer |
Tabelle 4: Übersicht Antidiabetika und Limitationes
|
Antidiabetikum |
Präparate (Beispiele) |
Limitationes |
|
Gut validierte Erstlinienmedikamente |
||
|
Metformin |
(Metfin®, Glucophage®) |
Keine |
|
Sulfonylharnstoffe |
Gliclazid (Diamicron® und Generika) |
Keine |
|
Insulin |
|
Keine |
|
Medikamente (vorwiegend) zur Kombinationstherapie |
||
|
GLP-1-Agonisten |
Liraglutid (Victoza®)
|
· In Kombination mit Metformin, einem SH oder einer Kombination aus Metformin und einem SH oder Metformin und Pioglitazon, wenn durch diese OAD keine ausreichende BZ-Kontrolle erreicht wird · In Kombination mit Basisinsulin ausschliesslich bei Patienten mit ungenügender BZ-Kontrolle unter vorgängiger Therapie mit Metformin und Victoza® · Mindestens BMI 28. Zusätzliche Medikamente zur Gewichtsreduktion werden nicht vom Krankenversicherer vergütet |
|
Dulaglutid (Trulicity®) |
· In Kombination mit Metformin, oder einer Kombination aus Metformin und einem SH oder Metformin und Pioglitazon, wenn die Behandlungen mit Metformin oder mit den jeweiligen Zweifachkombinationen ungenügend wirksam sind · In Kombination mit prandialem (kurzwirksamem) Insulin +/- Metformin, ausschliesslich bei Patienten mit ungenügender BZ-Kontrolle unter vorgängiger Therapie mit Metformin und Trulicity · Mindestens BMI 28. Zusätzliche Medikamente zur Gewichtsreduktion werden nicht vergütet |
|
|
|
Semaglutid (Ozempic®, Rybelsus®) |
· Zur Behandlung von Patienten mit einem Typ 2 Diabetes mellitus; in ausschliesslich folgenden Kombinationstherapien, wenn durch diese Antidiabetika keine ausreichende Blutzuckerkontrolle erreicht wird · Als Zweifachkombination mit Metformin oder einem Sulfonylharnstoff · Als Dreifachkombination mit einer Kombination aus Metformin und einem Sulfonylharnstoff · In Kombination mit Basisinsulin mit oder ohne Metformin · Mindestens BMI 28. Zusätzliche Medikamente zur Gewichtsreduktion werden nicht vom Krankenversicherer vergütet |
|
Gliptine (DPP-IV-Hemmer)
|
Saxagliptin (Onglyza®, |
· Ausschliesslich in Kombination mit Metformin, einem SH, Pioglitazon oder mit Insulin, wenn mit den bisherigen OAD oder mit Insulin keine ausreichende BZ-Kontrolle erreicht wird oder wenn eines der OAD nicht vertragen wird · Als Dreifachtherapie ausschliesslich in Kombination mit Metformin und einem SH, wenn mit Metformin und SH (als Zweifachkombination) keine ausreichende BZ-Kontrolle erreicht wird · Kombinationstherapien mit weiteren OAD –> Gutsprache durch den Krankenversicherer nach Konsultation des Vertrauensarztes |
|
Sitagliptin (Januvia®, |
· Für Patienten, welche mit den bisherigen OAD und/oder Insulin ungenügend eingestellt werden können oder diese nicht vertragen · Kombinationstherapien mit weiteren OAD, ausser SH und/oder Insulin –> Kostengutsprache durch den Krankenversicherer nach Konsultation des Vertrauensarztes |
|
|
Vildagliptin (Galvus®, |
· Für Patienten, welche mit den bisherigen OAD nur ungenügend eingestellt werden können oder diese nicht vertragen · Als Zweifachkombination mit Metformin oder SH oder Glitazon, wenn Metformin oder SH oder Glitazon allein keine ausreichende BZ-Kontrolle bieten · Als Dreifachkombination mit Metformin und SH, wenn Zweifach-kombination mit diesen Substanzen keine ausreichende BZ-Kontrolle bieten · In Kombination mit Insulin (+/- Metformin), wenn Diät, körperliche Bewegung und eine stabile Dosis Insulin keine ausreichende Blutzuckerkontrolle bieten · Kombinationstherapien mit weiteren oralen Antidiabetika –> Gutsprache durch den Vertrauensarzt der Krankenversicherer |
|
|
Linagliptin (Trajenta®, |
· Für Patienten, welche mit den bisherigen OAD nur ungenügend eingestellt werden können oder diese nicht vertragen · In Kombination ausschliesslich mit Metformin, einem SH, Glitazon oder einer Kombination aus Metformin und SH, wenn durch diese OAD keine ausreichende BZ-Kontrolle erreicht wird · Kombinationstherapien mit weiteren OAD –> Gutsprache durch Krankenversicherer nach vorgängiger Konsultation des Vertrauensarztes |
|
|
Alogliptin (Vipidia®, |
· Ausschliesslich in Kombination mit Metformin, einem SH oder mit Insulin, wenn mit den bisherigen Therapien keine ausreichende BZ-Kontrolle erreicht wird · Kombinationstherapien mit weiteren Antidiabetika –> Gutsprache durch den Krankenversicherer nach Konsultation des Vertrauensarztes |
|
|
SGLT-2-Inhibitor |
Empagliflozin (Jardiance®, |
· Als Monotherapie bei Patienten, die nicht mit Metformin behandelt werden können · In Kombination mit Metformin, allein oder in Kombination mit einem SH oder Insulin, allein oder in Kombination mit Metformin und/oder Sulfonylharnstoff, wenn mit diesen Behandlungen keine ausreichende BZ-Kontrolle erreicht wird · Kombinationstherapien mit weiteren OAD –> Gutsprache durch den Krankenversicherer nach Konsultation des Vertrauensarztes |
|
|
Dapagliflozin (Forxiga®) |
· Als Monotherapie, wenn durch Diät und gesteigerte körperliche Aktivität keine ausreichende Kontrolle der Glykämie erreicht wird · In Kombination mit oralen Antidiabetika (Metformin, DPP4-Inhibitoren, SH) und/oder Insulin (+/- Metformin), wenn diese Medikamente keine ausreichende BZ-Kontrolle ermöglichen · Kombinationstherapien mit weiteren Antidiabetika –> Gutsprache durch den Krankenversicherer nach Konsultation des Vertrauensarztes |
|
|
Canagliflozin (Invokana®, |
· Als Monotherapie bei Patienten, die nicht mit Metformin behandelt werden können · In Kombination mit Metformin, mit SH (+/- Metformin) oder mit Insulin (+/- Metformin), wenn mit diesen Behandlungen keine ausreichende BZ-Kontrolle erreicht wird · Kombination mit weiteren Antidiabetika –> Gutsprache durch den Krankenversicherer nach Konsultation des Vertrauensarztes |
|
Nicht empfohlene Antidiabetika |
||
|
Alpha- |
Acarbose (Glucobay®) |
Keine |
|
Pioglitazon |
Actos® |
· Anwendung, wenn die HbA1c-Werte mit anderen oralen Standard-Antidiabetika nicht erreicht werden können |
|
Glinide |
Repaglinid (NovoNorm® und Nateglinid (Starlix®) |
Keine |
6. Impressum
|
Diese Guideline wurde im März 2024 vollständig durchgesehen und aktualisiert. Herausgeberin Redaktion AutorInnen |
Diese Guideline wurde ohne externe Einflussnahme unter Mitarbeit aller regionalen mediX Netze und assoziierter Netze erstellt. Es bestehen keine finanziellen oder inhaltlichen Abhängigkeiten gegenüber der Industrie oder anderen Einrichtungen oder Interessengruppen. Sofern nicht anders ausgewiesen, gilt dies ausdrücklich auch für die Guideline-Autor*innen. mediX Guidelines enthalten therapeutische Handlungsempfehlungen für bestimmte Beschwerdebilder oder Behandlungssituationen. Jeder Patient muss jedoch nach seinen individuellen Gegebenheiten behandelt werden. mediX Guidelines werden mit grosser Sorgfalt entwickelt und geprüft, dennoch kann der Verein mediX schweiz für die Richtigkeit – insbesondere von Dosierungsangaben – keine Gewähr übernehmen. Alle mediX Guidelines im Internet unter www.medix.ch Der Verein mediX schweiz ist ein Zusammenschluss von Ärztenetzen und Ärzten in der Schweiz. Rückmeldungen bitte an: uwe.beise_at_medix.ch |