Guideline
Sexuell übertragbare Infektionen (STI)
Zuletzt revidiert: 02/2023 Letzte Änderung: 05/2023
- Guideline Kurzversion
- Patienteninformation Scabies (Krätze)

Für PatientInnen
Mehr zu diesem Thema erfahren Sie in unseren Gesundheitsdossiers.
Aktualisierung 05/2023
- Die Guideline wurde vollständig durchgesehen und auf Aktualität geprüft.
- Die Therapie der Gonorrhoe mit 1 g Ceftriaxon darf intramuskulär oder intravenös erfolgen. Bei Chlamydien hat Doxycyclin versus Azithromycin eine bessere Heilungsrate, insbesondere eine deutlich bessere bei analer Infektion, welche auch bei heterosexuellen Frauen häufiger ist.
- Bei PCR-Nachweis von Chlamydia trachomatis bei symptomatischen MSM (Männer die Sex mit Männern haben) wird empfohlen, aus der gleichen Probe zusätzlich die C. trachomatis Serotypen L1-L3/2b (= Erreger des Lymphogranuloma venereum) nachzubestellen, da die Prävalenz dieser Infektion massiv angestiegen ist und eine längere Therapiedauer erfordert als C. trachomatis.
- Neu ergänzt wurden die Tab. 3 zur Indikation und zum Zeitpunkt eines STI Screenings bei asymptomatischen Personen und/oder nach Risikosituation sowie ein Abschnitt zu M Pox (Affenpocken).
Vorbemerkungen
In dieser Guideline werden die sexuell übertragbaren Infektionen HIV/AIDS sowie Hepatitiden (s. entsprechende mediX GL Hepatitis und mediX GL HIV/Aids) nur erwähnt, sofern sie diagnostisch abgeklärt werden müssen. Allgemeine Hinweise zur Diagnose, Therapie und Beratung bei STI finden sich in der Kurzversion (WebApp). Therapieempfehlungen zu STI finden sich auch in der mediX GL Infektiologie.
1. Übersicht: Abklärung und Therapie STI
Tab. 1 listet die Leitsymptome und Differentialdiagnosen sexuell übertragbarer Infektionen (STI) bei extragenitalen klinischen Manifestationen auf. Tab. 2 zeigt den Abklärungsgang und die Therapie von STI bei genitalen Läsionen.
Tabelle 1. Leitsymptome und Differentialdiagnosen sexuell übertragbarer Infektionen
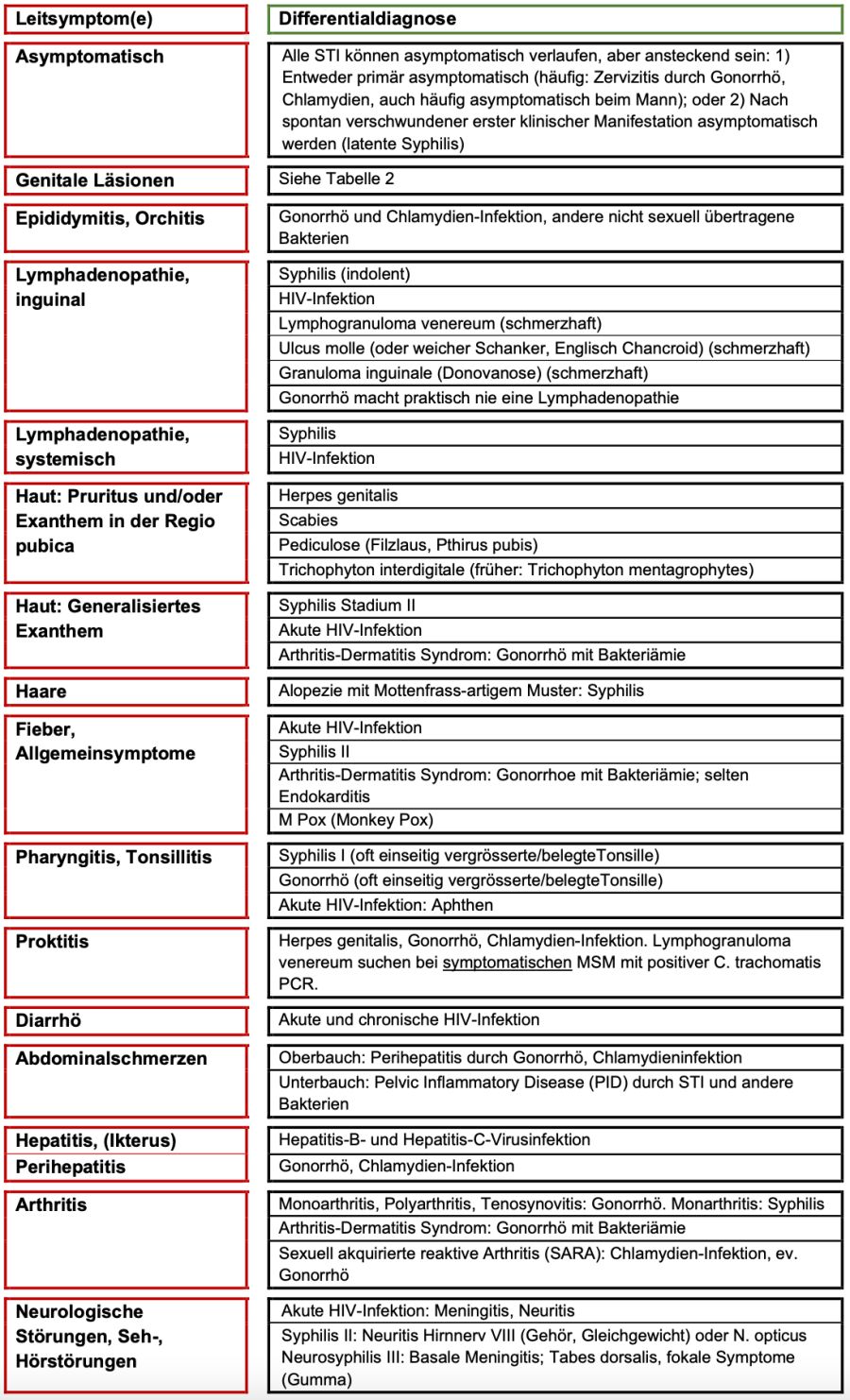
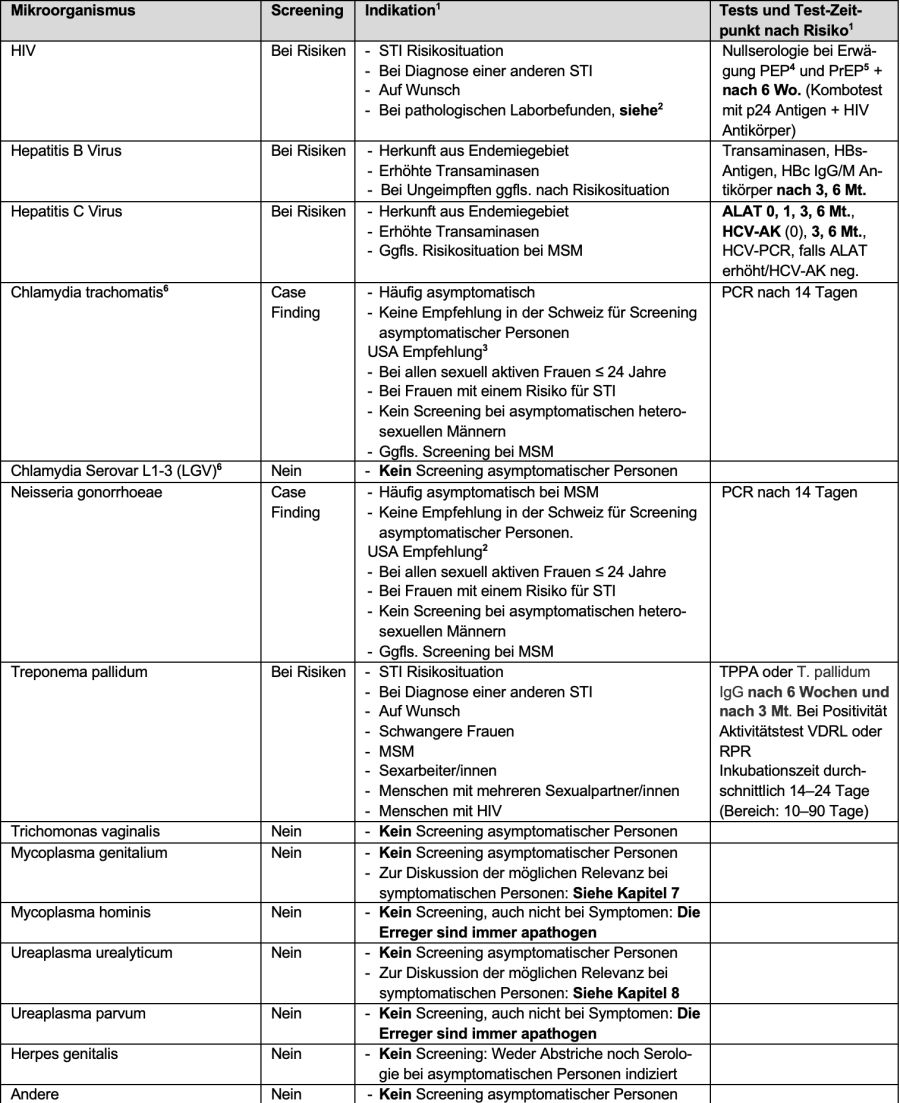
Tabelle 2. Genitale Manifestationen sexuell übertragbarer Infektionen: Diagnostik und Therapie (mod. nach [1])
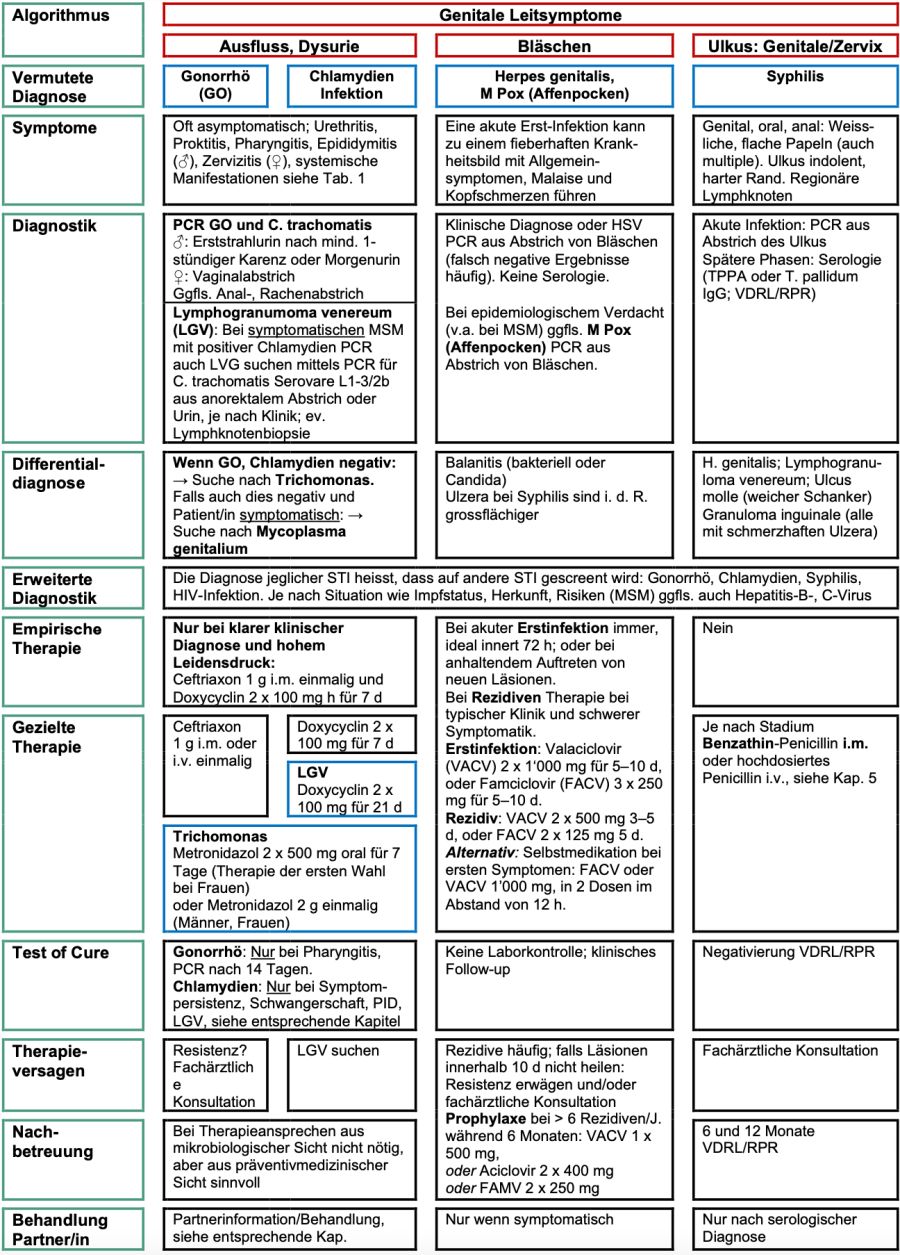
STI können asymptomatisch Verlaufen oder nach einer Risikosituation wird ein Screening gewünscht. Tab. 3 fasst die Indikationen, Testmethoden und den Zeitpunkt für ein Screening asymptomatischer Personen zusammen. Bei „anhaltendem“ Risiko siehe Fussnote1.
Tabelle 3. Indikationen und Zeitpunkt eines STI Screenings bei asymptomatischen Personen oder nach Risiko
* USPSTF
2. Allgemeines
Einleitung
- Die Differentialdiagnose von sexuell übertragbaren Infektionen (STI, sexually transmitted infections) soll nicht nur bei genitalen Läsionen erwogen werden, sondern auch bei pharyngealen, analen, systemischen – v. a. Fieber und „Allgemeinsymptome“ – dermatologischen und organbezogenen Symptomen (Arthritis, Hepatitis, zentralnervöse Beschwerden, etc.) (–> Tab. 1)
- Die Diagnose jeglicher STI soll immer die Suche nach anderen STI triggern
- Anzustreben ist eine gezielte antibiotische Therapie nach einer klaren Diagnosestellung. Dies einerseits, um „Kollateralschäden“ wie die Entwicklung von Antibiotikaresistenzen oder unerwünschte medikamentöse Wirkungen zu vermeiden; andererseits um spezifische STI korrekt zu therapieren: so ist z. B. die Therapiedauer von Chlamydia trachomatis Infektionen und Lymphogranuloma venereum unterschiedlich. Oder: Zu niedrig dosierte Penicillingaben können die Syphilis-Erreger vorübergehend reduzieren, wirken aber insbesondere bei Befall des Zentralnervensystems ungenügend
- STI haben nicht nur eine individualmedizinische, sondern auch eine Public Health Bedeutung: Meldepflicht, Partner/innen Behandlung, Unterbrechung von Infektionsketten.
Epidemiologie
- Die häufigsten STI sind humane Papillomviren (HPV), Herpesviren und Chlamydien
- Die klassischen STI Gonorrhö und Syphilis sind zwar deutlich seltener, treten aber in den letzten Jahren wieder vermehrt auf (2)
- Nach Reisen, bei Personen mit anderer geographischer Herkunft oder bei ungewöhnlichen klinischen Präsentationen sollen auch bei uns seltene STI erwogen werden wie: Pilzinfektionen in der Regio pubica (s. Kapitel 11), Ektoparasiten oder „exotische“ klassische STI aus fernen Endemiegebieten.
Meldepflicht
- Eine Meldepflicht besteht für: Neisseria gonorrhoeae, Treponema pallidum, Chlamydia trachomatis, Hepatitis A, B, C Viren sowie HIV/Aids. Die Erstmeldung erfolgt bei allen Krankheiten durchs Labor. Der kantonsärztliche Dienst bzw. das BAG fragen danach beim behandelnden Arzt nach
- Meldeformulare unter: BAG Meldeformulare.
Wichtige Aspekte für alle sexuell übertragbaren Krankheiten
- Alle Partner*innen der letzten 60 Tage vor Infektion sollen informiert, getestet und behandelt werden
- Alle Patient*innen mit einer diagnostizierten STI und deren Partner*innen auch auf die anderen STI testen, also immer Gonorrhö, Chlamydien, Lues, HIV, ggfls. Hepatitis-B- und Hepatitis-C-Virus
- Pharyngeale und rektale Infektionen verlaufen in > 90 % asymptomatisch
- Cave: Antibiotikaresistenzen bei Gonokokken (und M. genitalium)
- Deutliche Zunahme von Cephalosporin-Resistenz bei Gonokokken
- Bei Gonorrhö keine routinemässige Kombination von Ceftriaxon plus Azithromycin verordnen!
- Behandlungserfolg kontrollieren bei Rezidivtherapie
- Kultur (mit Resistenzprüfung) bei Rezidiv oder schlechtem Ansprechen
(> 2 d).
3. Gonorrhö (1–11)
Erreger, Inkubationszeit, Epidemiologie
Erreger
- Neisseria gonorrhoeae.
Inkubationszeit
- 2–4 Tage (1–7 Tage).
Prävalenz
- 100/100'000.
Neuinfektionen (CH)
- 1‘000 (Männer Sex mit Männern (MSM) 600–800)/Jahr.
Symptome
♂ Urethritis
- Oft asymptomatisch
- Eitriger Ausfluss, Pollakisurie, Hämaturie. Orificium urethrae kann geschwollen und gerötet sein. Fieber.
Beachte: Oft findet sich nur ein spärlicher seröser Ausfluss. Diese Männer sind tagsüber symptomfrei, nur vor der ersten Miktion kann morgens ein Eitertropfen (Bonjour-Tropfen) exprimiert werden. In ca. 10 % bestehen keine urogenitalen Symptome.
- Komplikationen: Prostatitis, Spermatocystitis, Funiculitis und Epididymitis.
♂ Epididymitis
♀ Urethritis, Zervizitis, Bartholinitis
- Meist asymptomatisch
- Weisslich-gelber Fluor, z. T. stechende Schmerzen oder Brennen bei der Miktion. Ev. Rötung und Ödem der Portio mit Kontaktblutung. Gelegentlich kann Eiter exprimiert werden. Menorrhagie und Metrorrhagie bei Beteiligung des Endometriums
- Komplikationen: Pelvic inflammatory disease (PID): Endometritis, Parametritis, Salpingitis, Oophoritis, Tuboovarialabszesse und Peritonitis. Sterilität (!).
♂/♀ Pharyngitis
- Meist asymptomatisch. Wichtige Differentialdiagnose bei einseitiger Tonsillitis (Gonorrhö und Lues I können einseitige Tonsillitis verursachen).
♂/♀ Proktitis
- Meist asymptomatisch.
Disseminierte Form
- Arthritis-Dermatitis-Syndrom, Tenosynovitis, Dermatitis, wandernde Polyarthritis, septische Monoarthritis, Meningitis, Endokarditis.
Beachte: Die Gonorrhö des Pharynx und des Anus ist in 90 % asymptomatisch und stellt ein wichtiges Erregerreservoir dar (3, 4).
Diagnostik
- PCR-Nachweis
♂: Erststrahlurin 10–20 ml (nach mindestens 1-stündiger Karenz oder Morgenurin) oder Urethralabstrich
♀: Vaginalabstrich, immer auf Gonokokken und Chlamydien (4, 8) - Sexualanamnese
♂ und ♀: Tonsillopharyngeal-, Analabstrich; bei MSM immer auch Tonsillopharyngeal-, Analabstrich, zusätzlich zur Urinprobe! - Abklärung auf Chlamydien, HIV und Syphilis.
Beachte: Ein zuverlässiger Nachweis von Chlamydien und Gonokokken ist in den ersten Tagen nach GV noch nicht möglich. Bei Kontakt mit einem dokumentiert infizierten Partner –> sofortige Therapie ohne weitere Abklärung. Handelt es sich um eine Routinekontrolle, ist diese erst nach 2–3 Wochen zu empfehlen.
Therapie
Grundsätze
- Diagnostische Abklärung anstreben und anschliessend gezielte Therapie (um Gefahr zunehmender Resistenzentwicklung entgegenzuwirken). Nur wenn die Klinik sehr typisch und ausgeprägt und der Leidensdruck hoch ist –> sofortige empirische Behandlung
- Partner mitbehandeln! (siehe unten)
Medikation (bei Urethritis, vaginaler, analer oder oropharyngealer Gonorrhö)

- Neu werden in der Schweiz sowohl die intramuskuläre (ventrogluteale) als auch die intravenöse Therapie mit 1 g Ceftriaxon empfohlen. Die Konzentration im Urin 24 h nach i.v. Verabreichung ist zwar etwas tiefer als nach i.m. Gabe, wird aber durch die Dosiserhöhung auf neu 1 g (früher 500 mg) aufgewogen
- Ertapenem 1 g i.m. war in einer randomisierten Studie gegenüber Ceftriaxon 500 mg i.m. non-inferior
- Wichtig: Bis vor kurzem wurde eine „empirische“ Therapie von Ceftriaxon (Cephalosporin) mit Azithromycin (Makrolid) zur potenteren Gonorrhö-Therapie (synergistische Therapie zur Vermeidung von Resistenzen) und gleichzeitiger empirischer Behandlung einer möglichen Chlamydieninfektion empfohlen. Diese Behandlungsstrategie wird – wegen rasch zunehmender Resistenzentwicklung von N. gonorrhoeae gegenüber Makroliden – nicht mehr empfohlen (3, 4). Eine zunehmende und rasche Resistenzentwicklung gegenüber Makroliden wird zudem auch bei Mycoplasma genitalium beobachtet, weswegen eine empirische Verwendung von Makroliden nicht mehr vertretbar ist
- Resistenzen: Ceftriaxon selten, Cefixim-Resistenzen steigend, Azithromycin unterschiedlich. Chinolone (z. B. Ciprofloxacin, Ofloxacin) nicht einsetzen, da häufig Resistenzen. Reiserückkehrer Thailand: Resistenzen!
Test of Cure
- Ist nur bei pharyngealer Infektion indiziert – frühestens nach 14 Tagen, da die PCR sonst falsch positiv ist. Tests of Cure bei analer oder genitaler Gonorrhö sind unnötig und nicht indiziert, ausser bei klinischem Verdacht auf Therapieversagen – frühestens nach 14 Tagen
- Bei verzögertem Therapieansprechen (> 2 d): Resistenztestung (mittels Kultur) und fachärztliches Konsilium.
Partner/innen-Behandlung
- Alle Partner der letzten 2 Monaten kontaktieren: Information, Testung und gleichzeitige Behandlung (wegen Infektiosität!).
- Partnertherapie ist in aller Regel eine empirische Therapie –> Testung der Sexualpartner ist empfohlen vor Therapiebeginn, aber kein Abwarten der Testergebnisse nötig
- Kein oder geschützter Geschlechtsverkehr für 1 Woche nach Therapiestart. Oralverkehr ist auch ansteckend!
- Alle Patient*innen mit einer diagnostizierten STI und deren Partner*innen auch auf die anderen STI testen, also immer Gonorrhö, Chlamydien, Lues, HIV, ggfls. – je nach Risikosituation – Hepatitis-B- und Hepatitis-C-Virus.
Screening
In den USA wird das Screening auf Infektionen mit Chlamydia trachomatis und Neisseria gonorrhoeae bei allen sexuell aktiven Frauen im Alter von ≤ 24 Jahren sowie bei älteren Frauen mit einem Risiko für sexuell übertragbare Infektionen (STI) gemäss USPSTF (U.S. Preventive Services Task Force) (9) empfohlen (Grad B), d. h.
- Aktuelle oder frühere STI
- Sexualpartner, von dem bekannt ist, dass er eine STI hat
- Neuer Sexualpartner
- Mehr als ein Sexualpartner oder Sexualpartner mit anderen Partnern
- Unbeständiger Gebrauch von Kondomen bei Personen in einer nicht monogamen Beziehung
- Bezahlter Sex (Geld oder Drogen).
In der Schweiz gibt es keine Empfehlung für ein systematisches Screening. siehe auch mediX GL Check-up.
- Screening kann bei Frauen mit Risiken für STI in Betracht gezogen werden und sollte mit einer Präventionsberatung einhergehen. Die Diagnose erfolgt idealerweise durch PCR aus einem Vaginal- oder Zervixabstrich, welcher etwas empfindlicher ist als jener aus dem ersten Urinstrahl
- Bei heterosexuellen Männern werden diese Tests nicht routinemässig empfohlen, wenn keine Symptome vorliegen, aber sie können in Risikosituationen in Betracht gezogen werden
- Bei Männern, die Sex mit Männern haben, ist ein regelmässiges Screening indiziert. Die Diagnose erfolgt durch PCR aus dem ersten Urinstrahl oder durch einen Abstrich aus der Harnröhrenöffnung (gleiche Empfindlichkeit)
- Bei Patientinnen und Patienten, die ein STI Screening wünschen, soll ein solches durchgeführt werden: HIV-Serologie, Lues-Serologie, PCR (Gonorrhoe und Chlamydien) aus einer Urinprobe und ggfls. zusätzlich – entsprechend anamnestischen Angaben zu Sexualpraktiken und ev. klinischen Manifestationen – auch Abstriche im Pharynx und anal. Mycoplasmen und Ureaplasmen sollen nicht gesucht werden (siehe entsprechende Kapitel dieser Guideline). Ein „Testen von gepoolten Proben“ wird nicht empfohlen.
⇒ Falls nach negativem Resultat auf Gonorrhoe und Chlamydien ggfls. weitere Erreger (z. B. Trichomonaden) gesucht werden sollen, kann eine entsprechende Untersuchung nachbestellt werden, ohne neues Probenmaterial zu gewinnen (die Labors bewahren das Extrakt als auch allfällig vorhandenes Rest-Probenmaterial auf und können daraus weitere PCR-Analysen durchführen).
4. Chlamydien-Infektion (1–6, 12–20)
Erreger, Inkubationszeit, Epidemiologie
Erreger
- Zwei Serotypen: 1. Chlamydia trachomatis (Serovar D-K); 2. Lymphogranuloma venereum (LGV), Serovar L1–3.
Inkubationszeit
- C. trachomatis 7–14 Tage, Lymphogranuloma venereum 3–30 Tage.
Epidemiologie
- Chlamydien sind die häufigsten Erreger der Nicht-Gonorrhö-Urethritis/-Zervizitis (NGU/NGZ), insbesondere bei sexuell aktiven Frauen/Männern < 25 J.
Symptome
♂ Urethritis
- Seröser Ausfluss, Algurie. Weniger akut und dolent als Go-Urethritis. Oft nur diskrete Rötung des Orificium urethrae und Verklebung der Harnröhrenmündung.
Proktitis bei anogenitalem Kontakt.
Prostatitis: Rolle von Chlamydien unklar. Bei 30–50 % symptomlos! Falls Symptome: Ähnlich wie Urethritis, schmerzhafte Prostata-Palpation; sehr selten, kontrovers.
Komplikationen
- Nebenhodenentzündung (häufig Chlamydieninfekt bei Männern < 35 J.), reaktive Arthritis.
♀ Meist asymptomatisch
Urethritis, Zervizitis
- Meist gelblich-weisslicher vaginaler Ausfluss mit Juckreiz am Introitus vaginalis. Kontaktblutungen oder Spotting nach Geschlechtsverkehr möglich. Bei bis zu
70 % symptomlos.
Komplikationen
- PID (Salpingitis, Oophoritis, Peritonitis). Klinik: Oft asymptomatisch; wenn Symptome: Unterbauchschmerzen, Ausfluss, Fieber, Schmerzen beim Geschlechtsverkehr, (neu aufgetretene) Dysmenorrhoe
- Perihepatitis
- Bei bilateralem Tubenverschluss Sterilität (häufige Ursache von Unfruchtbarkeit).
♂/♀ Pharyngitis
Meist asymptomatisch
♂/♀ Konjunktivitis
(auch bei Neugeborenen)
♂/♀ Anitis, Proktitis
♂/♀ Reaktive Arthritis
Lymphogranuloma venereum (LGV) (18–20)
Epidemiologie
- Endemisch bei Heterosexuellen in Ost/Westafrika, Indien, Teile Südostasiens und Karibik; steigende Zahlen bei Männern, die Sex mit Männern haben. In Europa sehr selten bei der heterosexuellen Bevölkerung. Steigende Zahlen bei Männern, die Sex mit Männern (MSM) haben: Die Prävalenz beträgt inzwischen 20-30% bei symptomatischen MSM mit positiver C. trachomatis PCR (18-20).
Klinik
- LGV manifestiert sich klinisch mit einem breiten Spektrum von wenig symptomatischen, nicht unterscheidbaren von C. trachomatis, bis zu den klassischen Manifestationen mit Ulzera, schmerzhaften Schwellungen und Rötungen im Bereich der Leisten, aus denen sich auch Eiter entleeren kann. Auch Allgemeinsymptome mit Fieber und starkem Krankheitsgefühl sind möglich. Ein Befall des Enddarms kann starke Schmerzen verursachen sowie Schleim- und Blutabgang im Stuhl verursachen
- An der Eintrittspforte der Erreger anlässlich der Infektion entsteht genital oder anal eine primäre Läsion, die an einen Lues-Primäraffekt erinnern kann, jedoch im Gegensatz zur Lues sehr schmerzhaft sein kann. Nach etwa 1–4 Wochen tritt eine schmerzhafte Lymphadenopathie der regionären Lymphknoten (Bubo) auf, die Fisteln bilden und exulzerieren können. Bei Männern, die Sex mit Männern haben, ist der anale Befall häufiger und eine inguinale Lymphknotenschwellung selten
- Das Spektrum der Verdachtsdiagnosen bei LVG reicht vom Analkarzinom bis hin zu Colitis ulcerosa oder Morbus Crohn.
Diagnostik
- PCR-Nachweis
♂: Erststrahlurin 10–20 ml (nach mindestens 1-stündiger Karenz oder Morgenurin)
♀: Vaginalabstrich; immer auf Chlamydien und Gonokokken (8)
Bei klinischem Verdacht auf LGV und bei allen symptomatischen MSM mit positiver C. trachomatis PCR –> Abstrich aus Läsion oder anorektaler Abstrich: Chlamydien-PCR durchführen lassen; bei positivem Befund kann spezifische LVG PCR im Labor aus gleicher Probe nachbestellt werden. - Antigen-Schnelltests („rapid immunoassays") haben eine geringe Sensitivität und sollen zur Diagnostik nicht verwendet werden (Cochrane-Review, 2020)
- Immer gleichzeitige Abklärung auf Gonorrhö, Syphilis, HIV.
⇒ Praktische Durchführung der Chlamydien-Diagnostik –> siehe auch Guidelines der Schweiz. Gesellschaft für Infektiologie (–> Tabelle in Abschnitt „Diagnostik“)
Wann Chlamydien suchen?
- Symptomatische Infektion
- Patienten mit anderen STI
- Sexualpartner mit bestätigter STI
- Hohes Risiko für Chlamydien-Infektion (z. B. MSM mit vielen wechselnden Sexualpartnern)
- Schwangerschaft
- Vor Einlegen eines IUD.
Beachte: Ein zuverlässiger Nachweis von Chlamydien und Gonokokken ist in den ersten Tagen nach GV noch nicht möglich. Erfolgte ein Kontakt mit einem dokumentiert infizierten Partner –> sofortige Therapie ohne weitere Abklärung. Handelt es sich um eine Routinekontrolle, ist diese erst nach 2–3 Wochen zu empfehlen.
Differentialdiagnose
- Falls keine Chlamydien oder Gonokokken nachweisbar sind: Auf Trichomonaden untersuchen (–> siehe Kapitel 6). Bei symptomatischen Personen mit negativen Befunden, v. a. bei sexueller Risikosituation, auf Mycoplasma genitalium untersuchen, nicht aber auf Ureaplasma sp.
Therapie
Grundsätze
- Diagnostische Abklärung anstreben und anschliessend gezielte Therapie (um Gefahr zunehmender Resistenzentwicklung entgegenzuwirken). Nur wenn die Klinik sehr typisch und ausgeprägt und der Leidensdruck hoch ist –> sofortige empirische Behandlung
- Partner mitbehandeln!

- „Pelvic inflammatory disease“ (PID)
- Rücksprache mit Gynäkologie/Infektiologie ratsam
- Empirische Abdeckung breites Erregersprektrum (Aerobier und Anaerobier und Chlamydien), falls kein Erregernachweis gelingt
- Grundsätzlich antibiotische Kombinationstherapie, z. B. mit Ceftriaxon 1 g/d i.m. oder i.v. x 7 d plus Doxycyclin 2 x 100 mg/d p.o. x 14 d plus Metronidazol 2 x 500 mg/d p.o. x 14 d
- Oder mit Co-Amocillin plus Doxycyclin.
Test of cure
Keine Kontrolle, wenn Patient/in unter der Therapie asymptomatisch geworden ist.
Indikation nur in folgenden Situationen; frühestens 4–6 Wochen nach Therapieende
- Symptompersistenz
- Zweifelhafter Adhärenz
- V. a. Reinfektion
- Schwangerschaft
- PID
- LGV
- Therapie mit Nicht-Erstlinienmedikamenten.
Testung auf Reinfektion
- 3–6 Monate nach Therapie in Erwägung ziehen; v. a. bei persistierendem Risiko für STI.
Partner/innen-Behandlung
- Ideal: Alle Sexualpartner der letzten 6 Monate; Minimum: Sexualpartner der letzten 4 Wochen
- Zeitgleiche Behandlung der regelmässigen Sexualpartner ist Voraussetzung für einen langfristigen Therapieerfolg
- Verzicht auf GV für eine Woche nach Behandlung
- Partnertherapie ist in aller Regel eine empirische Therapie –> Testung der Sexualpartner ist empfohlen vor Therapiebeginn, aber kein Abwarten der Testergebnisse nötig
- Alle Patient*innen mit einer diagnostizierten STI und deren Partner*innen auch auf die anderen STI testen, also immer Gonorrhö, Chlamydien, Lues, HIV, ggfls. – je nach Risikosituation – Hepatitis-B- und Hepatitis-C-Virus.
Screening
- Siehe Gonorrhö (–> Kap. 3).
5. Syphilis (1–6, 21–23)
Erreger, Inkubationszeit, Epidemiologie
Erreger
- Treponema pallidum.
Inkubationszeit
- 1–3 Wochen (7–100 Tage).
Neuerkrankungen (CH)
- 600–800 (300–600 MSM)/Jahr.
Symptome
Primärstadium
- Nach ca. 3 Wo. Primäraffekt (typisch: Sulcus coronarius/kleine Labien): Dunkelroter Fleck oder weissliche, flache Papeln, auch multiple, die rasch in eine Erosion übergehen. Ausdehnung und Tiefe des Defekts nehmen allmählich zu, nach 1–2 Wo. entsteht schmerzloses, scharf begrenztes, flaches Ulkus mit gelblich belegtem Grund und derbem, nicht unterminiertem Randwall. Kurz darauf bilaterale asymptomatische Lymphknotenschwellungen. Nach einigen Wochen Vernarbung.
Beachte: Atypische Formen sind häufig! Extragenital in ca. 10 % (z. B. Lippen, Mundhöhle, Enddarm).
Sekundärstadium
- 4–12 Wochen nach Infektion, mehrfaches, symptomärmeres Rezidivieren, später Übergang in symptomlose Lues latens
- AZ-Verschlechterung und Allgemeinsymptome: Müdigkeit, leichtes Fieber, Krankheitsgefühl, generalisierte Lymphadenopathie, Kopf-, Muskel-, Gelenkschmerzen, vorwiegend nachts
- Grosser Formenreichtum der Hauterscheinungen: Bei unklarem Exanthem auch an Syphilis denken! Kein Juckreiz!
- Befall von Handtellern und Fusssohlen
- Roseola: Livides, makulöses Exanthem, später: Papulöse und ulzeröse Syphilide; Condylomata lata: Nässende Papeln in intertriginösen Räumen. Mundschleimhauterscheinungen: Makulopapulöses Syphilid (feste, flache Läsionen, oft am Gaumen); Plaques muqueuses: Leicht erhabene oder flach ulzeröse Läsionen mit entzündlichem Rand; schmerzhafte Ulzerationen
- Grundsätzlich können alle Organe betroffen sein, auch das Zentralnervensystem
- Selten Augen-, Ohrenmitbeteiligung, Leber-Nieren-Muskelbeteiligung.
Latente Syphilis
- Klinisch asymptomatisch (Lokalbefund spontan und narbenfrei ausgeheilt)
- Labor: Serologisch aktive Infektion (VDRL positiv).
Tertiärstadium
- Meist ab 3.–5. Krankheitsjahr mit irreversiblen Schäden
- Tubero-serpiginöse Syphilide: Bogig begrenzte, chronische Hautinfiltrate mit bräunlich-blau-rotem Farbton und zentraler Atrophie
- Gummen: Gummiartige Granulome in parenchymatösen Organen, Knochen und Bindegewebe
- Mesaortitis luetica: Gefahr des Aortenaneurysmas
- Neurosyphilis, basale Meningitis (frühes Tertiärstadium)
- Tabes dorsalis mit lanzinierenden Schmerzen, Ataxie, Schwinden der Patellar- und Achillessehnenreflexe
- Progressive Paralyse mit Veränderung der Persönlichkeit und Demenz.
Beachte: Befall des peripheren oder zentralen Nervensystems auch im Stadium II und III möglich.
Diagnostik
- Bei V. a. Primär-Syphilis: Treponema pallidum-Nachweis aus Läsion (PCR), Serologien können zu diesem Zeitpunkt noch negativ sein
- Bei späteren Stadien: Serologie (Screening und Bestätigungstest)
- PCR (Abstrich aus Läsion) besonders bei extragenitalen Manifestationen, unklaren genitalen Läsionen, nässende Läsionen bei Sekundärsyphilis
- Direkter Erregernachweis mittels Dunkelfeldmikroskopie aus Reizsekret kann nur in einer Dermatologie (oder ggfls. STI-Klinik) erfolgen
- Suchtest (Serologie)
- TPPA (Treponema Pallidum Particle Agglutination Assay) oder T. pallidum IgG
–> Wenn positiv: Aktivitäts-Test durchführen (s. u.).
- TPPA (Treponema Pallidum Particle Agglutination Assay) oder T. pallidum IgG
- Aktivitätstest
- VDRL (Venereal-Disease-Research-Laboratory)-Test oder RPR (Rapid-Plasma-Reagin)-Test
–> Wenn positiv: Diagnose aktive Lues (–> Therapie)
–> Wenn negativ: St. n. behandelter Lues?, FTA (Fluorescent Treponemal Antibody Absorption) oder EIA (Enzyme-linked Immunosorbent Assay) –> wenn negativ wahrscheinlich TPPA falsch positiv (Rücksprache Labor!)
- VDRL (Venereal-Disease-Research-Laboratory)-Test oder RPR (Rapid-Plasma-Reagin)-Test
- Lues-Serologie: Titer und Verlauf
- Keine Lumbalpunktion mehr bei Frühsyphilis! Bei Verdacht auf Neurolues Liquorpunktion: TPPA/IgG-Liquor-Serum-Index
- Immer Abklärung Gonorrhö, HIV, nicht-gonorrhoische Urethritis (NGU)/nicht-gonorrhoische Zervizitis NGZ!
Therapie
Wichtige Aspekte
- Sexualpartner/innen bei primärer Syphilis (bis 90 Tage) und bei sekundärer Syphilis (bis 6 Monate) kontaktieren und empirisch behandeln
- Sexuelle Kontakte bis Therapieabschluss vermeiden
- Meldepflicht
- Benzathin-Penicillin muss über die Kantonsapotheke oder internationale Apotheken bestellt werden (Importprodukt), da in der Schweiz nicht registriert
- Zur Behandlung der Syphilis/Lues I und II eignet sich ausschliesslich das lang wirksame Benzathin-Penicillin; kein anderes Präparat möglich
- Bei Befall des Zentralnervensystems, inkl. Augen, Ohren und Gleichgewichtsorgan, ist eine hochdosierte intravenöse Penicillin-Therapie über 14 Tage notwendig.
Frühsyphilis
–> Primärsyphilis, Sekundärsyphilis oder latente Syphilis bis 1 Jahr post infectionem

* Die Jarisch-Herxheimer Reaktion ist eine akute febrile Reaktion (mit Kopfschmerzen, Myalgien, Hypotonie), welche vor allem bei der Behandlung einer frühen Syphilis auftreten kann. Die Reaktion beginnt 1–2 h nach Penicillingabe, ist nach 8 h am ausgeprägtesten und verschwindet nach 24–36 h. Die Ursache ist nicht eine Allergie auf Penicillin, sondern vermutlich eine Zytokinantwort auf freigesetzte T. pallidum Membranproteine. Die Patienten/innen sollen über die Möglichkeit einer solchen Reaktion aufgeklärt werden, die zwar selten ist, aber sehr selten auch lebensbedrohlich werden kann. Aufgrund früher Studien können zur Prävention ca. 30 Min. vor der Therapie 50 mg Prednison p.o. verabreicht werden (14), welches im Falle des Auftretens der Reaktion bis 3 Tage weitergegeben werden kann. Andere Empfehlungen schlagen Antipyretika vor; alles ohne Evidenz aus neueren Untersuchungen.
Spätsyphilis
–> Alle Krankheitsstadien, die später als 1 Jahr post infectionem diagnostiziert werden (latente Syphilis, Tertiärsyphilis) oder eine Syphilis unbekannter Dauer

Neurosyphilis
–> Zentralnervensystem, inkl. Augen und Ohren
![]()
Verlaufskontrollen
- Quantitativer VDRL (Veneral-Disease-Research-Laboratory-Test) oder RPR Test (Rapid Plasma Reagin) nach 3, 6, 12 Monaten, im Einzelfall auch länger. Bei Lues I/II sollte Titer gefallen sein: Nach 6 Monaten um 2 Stufen, nach 12 Monaten um 3 Stufen, nach 24 Monaten um 4 Stufen
- In der Regel negativiert sich der VDRL-Titer bei erfolgreicher Therapie.
–> Bei fehlendem Abfall oder Wiederanstieg
- Reinfektion? Neurolues?
- Rücksprache mit Spezialisten.
Partnernotifikation und Behandlung
- Behandlung nur nach Diagnostik; keine empirische Therapie.
Screening
Ein Screening auf Syphilis (mit TPHA- oder TPPA-Test) wird bei folgenden Personen empfohlen (siehe auch mediX GL Check-up)
- Schwangere Frauen
- Männer, die Sex mit Männern haben
- Sexarbeiter/innen
- Menschen mit mehreren Sexualpartnerinnen oder Sexualpartnern
- Menschen mit HIV-Diagnose
Die optimale Häufigkeit dieser Vorsorgeuntersuchungen ist nicht eindeutig festgelegt. Bei Personen mit Risiken für sexuell übertragbare Infektionen können jährliche Kontrollen sinnvoll sein. Das Screening bietet die Gelegenheit, Ratschläge zur Prävention anderer sexuell übertragbarer Infektionen zu vermitteln.
Die US Preventive Services Task Force (USPSTF) empfiehlt, dass alle schwangeren Frauen auf Syphilis getestet werden sollen (Grad A). Die Empfehlung befindet sich z. Zt. in Revision.
6. Trichomoniasis (T. vaginalis) (1–6, 24–25)
Erreger, Epidemiologie
Erreger
- Die Infektion durch das Protozoon T. vaginalis gehört global zu den häufigsten sexuell übertragbaren Erkrankungen. Aktuelle Zahlen aus der Schweiz oder Europa liegen nicht vor.
Epidemiologie
- Über 70 % der Infizierten haben minimale oder keine Symptome
- Unbehandelte Infektionen können Monate oder Jahre persistieren
- Eine aktive Diagnostik bei Partner/innen von Infizierten ist sinnvoll
- Die T. vaginalis-Infektion ist assoziiert mit einer häufigeren Akquisition einer HIV-Infektion
- Bei schwangeren Frauen kann die Infektion zu vorzeitiger Geburt und anderen unerwünschten Folgen führen
- Ob das Rektum auch ein Reservoir für T. vaginalis darstellt, ist unklar. Orale Infektionen sind unbekannt.
Symptome
- Die Infektion verläuft mehrheitlich asymptomatisch
- Männer: T. vaginalis kann zu Urethritis, Epididymitis oder Prostatitis führen
- Frauen: Schlecht riechender gelblich-grüner vaginaler Ausfluss mit oder ohne Vulvitis.
Komplikationen
- Erhöhte Anfälligkeit für eine HIV-Akquisition
- Wahrscheinlich auch Pelvic Inflammatory Syndrom möglich als Folge einer Infektion
- Frühzeitige Geburt bei schwangeren Frauen.
Diagnostik
- Eine Diagnostik auf T. vaginalis soll bei Frauen mit vaginalem Ausfluss durchgeführt werden oder bei einem STI -Screening bei Personen mit erhöhtem Risiko für sexuell übertragbare Infektionen
- Die Direktmikroskopie von direkten Ausstrichen aus Vaginal-/Zervikalsekret hat eine schlechte Sensitivität von 50–65 %. Die Kultur war vor der molekularen Diagnostik der Gold-Standard mit einer Sensitivität von 75–95 % und einer Spezifität von 100 %
- Molekularer Nachweis (DNA Nachweis) aus Vagina-/Zervixabstrich, Urethralabstrich, Erststrahl-Urin (max. 20 ml) oder Ejakulat; CHF 90.–, nicht kassenpflichtig
- Nach der PCR-Analyse auf Chlamydien oder Gonokokken bewahren Labore das Extrakt als auch allfällig vorhandenes Rest-Probenmaterial auf und können daraus bei Bedarf weitere PCR-Analysen (wie PCR auf T. vaginalis) durchführen.
Therapie
- Metronidazol 2 g oral in einer Einmaldosis
oder Tinidazol 2 g oral in einer Einmaldosis - Metronidazol 2 x 500 mg oral für 7 Tage (eine randomisierte Studie favorisiert diese 7-Tage-Therapie, aber die Einnahme-Compliance einer länger dauernden Therapie ist wohl vermindert)
- Partner-/innen-Therapie
- Therapiekontrolle wegen hoher Reinfektionsrate kontrovers
- Persistierende Infektionen bzw. Therapieversagen aufgrund einer antimikrobiellen Resistenz gegenüber Imidazolen ist selten, aber möglich.
Alternativen
- Imidazole sind die einzige mögliche Therapieoption
- Topische Substanzen wurden nur anekdotisch berichtet und haben eine unsichere Wirkung.
Schwangerschaft
- Einmaldosis 2 g Metronidazol erlaubt.
Partnerbehandlung
- Ja.
Prävention
Kondomgebrauch.
7. Mykoplasmen (1-6, 26-28)
Erreger, Epidemiologie
- Mycoplasma genitalium (MG) ist potentiell pathogen; Mycoplasma hominis ist aufgrund der wissenschaftlichen Evidenz kaum verantwortlich für symptomatische Infektionen der ableitenden Harnwege und ist als Ursache für eine Urethritis unwahrscheinlich
- M. genitalium kann die Schleimhaut des Urogenitaltrakts kolonisieren, ist sexuell übertragbar und kann zu symptomatischen Infektionen führen. Die Mehrzahl der M. genitalium-Infektionen verläuft aber asymptomatisch
- Eine Kolonisation des Urogenitaltrakts ist häufig transient und verschwindet häufig spontan
- Ein Screening und/oder eine Behandlung von asymptomatischen Personen ist nicht indiziert
- M. genitalium kann als Ursache einer nicht-gonorrhoischen Urethritis (NGU) und nichtgonorrhoische Nicht-Chlamydien-Urethritis (NCNGU) eine Rolle spielen
- Bei symptomatischen Männern mit NCNGU lässt sich bei 5–35 % M. genitalium nachweisen
- Antibiotika-Resistenzen (Makrolide, Chinolone) führen zunehmend zu therapeutischen Problemen
- Gesucht wird der Erreger nur bei symptomatischen Personen, bei welchen die Diagnostik betr. Gonokokken, Chlamydien und Trichomonaden negativ verlief.
Symptome
Die Mehrzahl der M. genitalium-Infektionen verläuft asymptomatisch. Falls Symptome
Frauen
- Dysurie
- Kontaktblutungen (post-koital)
- Zwischenblutungen
- Zervizitis
- Schmerzen im Unterleib
- Sexuell akquirierte reaktive Arthritis (SARA)
- Tubeninfertilität
- Pelvic inflammatory disease (PID)
- Möglicherweise: Frühgeburten, Aborte.
Männer
- Dysurie
- Ausfluss aus der Harnröhre, Harnröhren-Beschwerden
- Urethritis (akut, persistent oder rezidivierend)
- Balanitis
- Bei MSM: Gelegentlich Proktitis
- Sexuell akquirierte reaktive Arthritis (SARA)
- Epididymo-Orchitis, Prostatitis.
Diagnostik
- Bei symptomatischen Patientinnen und Patienten zuerst nach häufigen STI-Erregern wie Gonokokken, Chlamydia trachomatis und Trichomonas suchen. Falls keiner der Erreger gefunden wird, auf M. genitalium screenen.
⇒ Nach der PCR-Analyse auf Chlamydien oder Gonokokken bewahren Labore das Extrakt als auch allfällig vorhandenes Rest-Probenmaterial auf und können daraus bei Bedarf weitere PCR-Analysen (wie PCR auf Mycoplasma genitalium) durchführen. - Nachweis mittels PCR Methode.
Probenmaterial
- Männer: Urethral-Abstrich, Erststrahl-Urin nur, wenn Abstrich vom Patienten abgelehnt, da weniger sensitiv; bei Proktitis: Rektalabstrich
- Frauen: Vaginalabstrich vulvovaginal; zusätzlicher endozervikaler Abstrich steigert Sensitivität; Urinprobe weniger sensitiv als Abstrich
- Alle Tests mind. 1 h nach der letzten Miktion
- Eine (genetische) Resistenzprüfung sollte generell angestrebt werden (v. a. Makrolid-Resistenzmutation).
Therapie
Bei symptomatischen Personen wird M. genitalium therapiert.
Makrolid-Empfindlichkeit (oder keine Resistenzprüfung verfügbar)
- Doxycyclin 2 x 100 mg für 7 d; danach Azithromycin 1 x 1 g für Tag 1, dann 1 x 500 mg an Tagen 2–4.
Makrolidresistenz
- Doxycyclin 2 x 100 mg für 7 d; danach Moxifloxacin 1 x 400 mg für 7–10 d.
Bei schweren Infektionen (PID, Epididymitis)
- Moxifloxacin 1 x 400 mg p.o. für 14 d.
Bei Multiresistenz
- Kontakt mit Infektiologie oder STI-Klinik.
Schwangerschaft
- Chinolone/Moxifloxacin kontraindiziert.
Test of cure
- Klinische Nachkontrolle; wenn keine Symptome mehr vorhanden sind, keine Therapieerfolgskontrolle nötig.
Partnerbehandlung
- Regelmässige Sexualpartner/innen sollten getestet und bei positivem Befund behandelt werden ⇒ Verhinderung Reinfektion
- Keine Empfehlung für Partnernotifikation bei Gelegenheitspartner/innen
- Partner/innen mit gleicher, wirksamer Therapie behandeln
- Patienten sollten, nach Beendigung der Behandlung für 7 Tage bzw. bis die Symptome abgeklungen sind, auf sexuelle Kontakte verzichten.
8. Ureaplasmen (1-6, 29)
Ob Ureaplasma parvum and Ureaplasma urealyticum eine pathogene Rolle im Genitaltrakt oder als Ursache von Aborten eine Rolle spielen könnten, wird kontrovers diskutiert. Beide Erreger kolonisieren den Urogenitaltrakt häufig.
Überwiegend wahrscheinlich ist U. parvum apathogen. Falls U. urealyticum überhaupt pathogen ist, dann wahrscheinlich nur bei einzelnen Personen mit besonderen Risiken.
Das European STI Guidelines Editorial Board machte im Jahr 2018 das folgende Statement (19)
- „Zur Zeit gibt es keine Evidenz, dass wir mehr nützen als schaden mit der Diagnostik und in der Folge mit der Therapie von Mycoplasma hominis, Ureaplasma parvum und Ureaplasma urealyticum Kolonisationen oder Infektionen“
- Deshalb wird die Suche nach diesen Erregern weder bei asymptomatischen noch bei symptomatischen Männern und Frauen empfohlen
- Die asymptomatische Kolonisierung mit diesen Erregern ist häufig und die Mehrheit der Kolonisierten entwickelt keine Erkrankung
- Obwohl U. urealyticum bei Männern mit Urethritis assoziiert wurde, ist der Erreger wahrscheinlich meist nicht Ursache für eine Urethritis, ausser wenn eine hohe Erregerdichte vorhanden ist. Das extensive Testen und die folgende Therapie führt nicht nur zur Selektion von resistenten Ureaplasmen, sondern trägt vor allem auch zur Resistenzbildung von „wirklichen” Erregern einer STI bei; weiterhin wird dadurch das Mikrobiom geschädigt und es entstehen erheblichen Kosten für die Gesellschaft und die Individuen, v. a. für Frauen
- Eine Therapie von U. urealyticum sollte nur bei Männern mit anderweitig nicht erklärter Urethritis und mit hoher U. urealyticum Erregerlast erwogen werden. Es liegt jedoch keine Evidenz für eine effektive Therapie vor.
⇒ mediX empfiehlt: Ureaplasma sollen weder bei asymptomatischen noch bei symptomatischen Personen gesucht werden. Die zum Teil beobachteten wiederholten Therapieversuche sind unbedingt zu vermeiden.
9. Herpes genitalis (1–6, 30–32)
Erreger, Inkubationszeit, Epidemiologie
Erreger
- Bei 80 % HSV-2, bei 20 % HSV-1.
Infektiosität
- Bläschen > keine Bläschen > aktuelle Therapie.
Inkubationszeit
- 2–12 Tage.
Prävalenz
- 19 %.
Risiko/Kontakt
- 50 % nach 2 Monaten (25 x Geschlechtsverkehr).
Symptome
- Prodrome: Grippeähnliche Symptome, ev. LK-Schwellungen
- Lokal: Flüssigkeitsgefüllte Bläschen, die eintrüben und platzen und kleine Ulzera bilden. Typisch: Gruppen von schmerzhaften Läsionen am Genitale, am Gesäss und angrenzenden Arealen. Ausserdem: Überempfindlichkeit, Juckreiz, Brennen. Algurie bei urethralem Befall, Abdominalbeschwerden bei analem Befall. 20–30 % der Infizierten sind symptomlos, atypische Läsionen sind nicht selten.
Hinweis: Bei seropositiven Patienten für HSV-2 findet man eine Virusausscheidung und somit Ansteckungsgefahr auch ohne Vorgeschichte eines floriden genitalen Herpes (20–22).
Diagnostik
- Bei typischem Erscheinungsbild kann die Diagnose klinisch gestellt werden; in unklaren Situationen: –> Abstrich Kruste oder Bläscheninhalt: PCR (Stäbchen in sterilem Medium) oder Kultur (Virus-Transportmedium).
Therapie
Erstmanifestation
- Verläuft oft besonders schwer. Therapiebeginn so früh wie möglich (innerhalb 72 h oder bei anhaltender Bildung von neuen Bläschen auch später): Valaciclovir (VACV) 2 x 1’000 mg/d für 5–10 d; 2. Wahl: Famciclovir (FACV) 3 x 250 mg/d für 5–10 d
- Zusätzlich bei Bedarf Analgetika.
Hinweis: Die Behandlung der Erstmanifestation beeinflusst die Rezidivrate nicht.
Rezidiv
- Im Laufe der Zeit meist weniger Therapie fakultativ (Beschwerden werden um 1–2 d verkürzt): VACV 2 x 500 mg/d für 3–5 d. 2. Wahl: FACV 2 x 125 mg/d für 5 d.
Alternativ: Selbstmedikation bei ersten Anzeichen mit FACV oder VACV 1’000 mg, 2 Dosen in Abständen von 12 h.
Dauersuppression (Kostengutsprache), i. d. R. bei > 6 Rezidiven/Jahr
- Bei häufigen Rezidiven und hohem VACV 1 x 500 mg/d für 6–12 Monate (Dauersuppression). Resultate: Weniger Rezidive, reduzierte Virusausscheidung, gute Verträglichkeit und Wirksamkeit über bis zu 18 Jahre dokumentiert mit ACV.
Kontrollen: Einmal jährlich, ev. Absetzversuch (dann aber oft wieder häufiger Rezidive) - Medikamente 2. Wahl: Acyclovir 2 x 400 mg/d oder FACV 2 x 250 mg/d.
Beachte
- Topische antivirale Therapie (z. B. mit Acyclovir) wird nicht empfohlen (Resistenzbildung!). In der akuten Phase können aber z. B. Betadine-Sitzbäder und Tannosynt®-Lotion oder -Schüttelmixtur eingesetzt werden, in der abheilenden Phase dann z. B. Bepanthen®-Creme
- Kondome werden empfohlen. Sie bieten zwar keinen sicheren Schutz vor Übertragung, mindern aber wahrscheinlich das Übertragungsrisiko. Auch unter Suppressionstherapie ist eine Übertragung möglich. Das Risiko ist aber um etwa 50 % geringer (8).
10. Condylomata acuminata (Genitalwarzen) (33)
Erreger, Epidemiologie
Erreger
- Low risk Humane Papillomaviren HPV 6, 11 (High risk HPV 16, 18, 31 und andere als Ursache von Zervix-, Vulva-, Penis-, Analkarzinomen).
Epidemiologie
- Häufigste virale STI.
Symptome
- Fast immer symptomlos. Genitalwarzen können über Monate und Jahre persistieren. Bis 30 % Spontanheilung.
Komplikationen
- Äusserst selten maligne Entartung der Warzen zum Penis-/Vulvakarzinom. Im Gegensatz dazu sind High-risk-HP-Viren praktisch an allen Zervixkarzinomen ursächlich beteiligt.
Diagnostik
- Klinisch. Keine HPV-Serologie. Seltene Indikationen zu einer weitergehenden Diagnostik (Histologie) sind: Unsichere klinische Diagnose, Therapieresistenz, Frührezidive, Grössenzunahme trotz Therapie
- HIV-Serologie!
- Bei Verdacht auf analen Befall und/oder anale HPV-assoziierte Dysplasien soll bei Personen, die analen Sex haben, eine proktologische Abklärung mit Anoskopie erwogen werden (Evidence of benefit not known).
Therapie
- Aufgrund gewisser Spontanheilungstendenz kann Abwarten bei wenigen Läsionen eine Option sein (Aufklärung des Patienten)
- Die Wahl des Behandlungsverfahrens soll individuell getroffen werden. Kriterien sind u. a. Lokalisation, Warzengrösse und -zahl, Nebenwirkungen, Patientenpräferenz und Kosten.
⇒ Kleinflächige Läsionen: Kryotherapie oder mechanische Abtragung (Cave: Mögliche Narbenbildung, bei kryochirurgischer Therapie häufig persistierend Hypopigmentierung im behandelten Areal, deshalb ev. aus kosmetischen Gründen auch hier bevorzugt Aldara® wie bei grösserflächigen Läsionen)
⇒ Grösserflächige Läsionen: Imiquimod 5 %, Aldara®.
Medikamentös
- Podophyllotoxin wird nicht mehr empfohlen (kann aber fachärztlich noch angewendet werden)
- Imiquimod (Aldara®) ist wegen deutlich höheren Kosten nur 2. Wahl, wenn mechanische Verfahren kontraindiziert sind. Anwendung: Imiquimod 5 %
3 x/Woche (Tag 1, 3, 5) vor dem Schlafen (6–10 h belassen), max. 16 Wochen. Kosten: 12 Sachets CHF 143.35 für 4 Wochen Therapie; Supp von Kantonsapotheke erhältlich.
Mechanische Verfahren: Kryotherapie, Elektrochirurgie, Exzision, CO2-Lasertherapie
- Da Condylomata acuminata häufig genital gruppiert auf grösseren Flächen vorkommen, ist in diesen Fällen von einer Vereisung oder Chirurgie abzuraten, da danach sehr schmerzhaft bei grosser Fläche
- Einzelne Läsionen können gut mechanisch behandelt werden
- Der Laser ist bei Nichtansprechen eine gute wenn auch teure Option und wird nur von Spezialist*innen mit entsprechendem Sicherheitsraum angeboten („verdampfende“ aerosolisierte Viren sind für die Umgebung gefährlich!).
Hinweis
- Die Therapie gelingt meist innert 3 Monaten. Ein Wechsel auf eine andere Therapieform sollte erfolgen, wenn kein ausreichender Therapieerfolg nach vollständigem Behandlungszyklus erkennbar ist oder zu starke Nebenwirkungen auftreten.
Prävention
- Kondome können Risiko der Infektion reduzieren, aber nicht eliminieren
- Der 9-valente HPV Impfstoff (Gardasil® 9) schützt vor Papillomavirus Typen 6, 11, 16, 18, 31, 33, 45, 52, 58). Indikationen zur Impfung: siehe mediX Factsheet Impfungen und aktuellen Schweizerischen Impfplan.
11. Andere: Pilze, Ektoparasiten, „exotische“ STI
Pilzinfektion Regio pubica durch Trichophyton (34, 35)
Neben den bekannten Hautmykosen im Inguinal- und Genitalbereich wurde eine neuartige klinische Manifestation einer Pilzinfektion durch Trichophyton interdigitale (auch Trichophyton mentagrophytes Genotyp VII genannt) beschrieben, die sexuell übertragen werden kann und zu äusserst starken Entzündungen der Haut in der Regio pubica führen kann.
- Bisher bei Reiserückkehrenden aus Südostasien und deren Kontakten, aber auch bei Personen ohne Reiseanamnese beschrieben
- Sehr entzündliche, schmerzhafte und persistierende Infektion der pubogenitalen Region
- Diagnostik mittels Kultur auf Pilze; Typisierung mittels DNA Analyse
- Therapie mittels systemischen Antimykotika.
Ektoparasiten Regio pubica (36, 37)
Ektoparasiten sind bei Juckreiz in der Regio pubica oder in der Pubesbehaarung zu erwägen.
Filzlaus (Pediculosis pubis, durch Pthirus pubis)
- Juckreiz: Klinische Diagnose (von Auge sichtbar); Therapie mit Permethrin 5 % Lotio oder Malathion 0,5 % Lotio, Einmalanwendung 8–12 h; nach 7–10 d wiederholen. Kleider, Bettwäsche, Handtücher etc. entweder heiss waschen, über 50 °C oder in luftdicht verschlossenem Plastiksack für 3 d aufbewahren. Partnerbehandlung (Partner innerhalb 3 Monaten).
Scabies (Sarcoptes scabiei var. hominis)
- –> Siehe auch mediX GL Migrationsmedizin
- Kann auch sexuell übertragen werden; Juckreiz, Hautbefunde. Klinische Diagnose oder mikroskopischer Nachweis von Milben, Eiern und Kybala (Kot) aus den Milbengängen. Therapie mit Ivermectin peroral (Stromectol; kontraindiziert in der Schwangerschaft) oder lokale Therapie mit Permethrin
5 % Lotio (nach 8–12 h abduschen oder abwaschen; Nachbehandlung nach 14 Tagen). Partnerbehandlung.
STI in anderen geographischen Regionen
Ulcus molle (oder weicher Schanker, Englisch Chancroid) 38)
- Bakterielle Infektion durch Haemophilus ducreyi verursacht; Inkubationszeit 10–14 d
- In Europa selten; Vorkommen: V. a. in tropischen Ländern (z. B. Südostasien, Afrika, Lateinamerika)
- Männer 5 x häufiger betroffen als Frauen
- Klinisch charakterisiert durch ein oder mehrere schmerzhafte genitale Ulzera mit weichem Randsaum, welche unbehandelt bis zu mehreren Monate lang persistieren können; regionale Lymphadenopathie, die nach aussen eitrig aufbrechen kann (Bubo genannt)
- H. ducreyi ist schwierig zu kultivieren. Nachweis mittels PCR aus Abstrich
- Therapie mit Ceftriaxon oder Azithromycin als Einmalgabe oder Ciprofloxacin für 3 d.
Granuloma inguinale (Donovanose) (39)
- Bakterielle Infektion mit Klebsiella granulomatis (früher: Calymmatobacterium granulomatis); Inkubationszeit rund 50 d
- Endemisch in Papua New Guinea, Südafrika, Indien, Brasilien und Australien
- Charakteristische schmerzloseUlzera im Genitalbereich, die unbehandelt gewebszerstörend sind. Manifestationsformen: Ulzerogranulomatös, hypertrophisch, nekrotisch und sklerotisch
- Diagnose durch mikroskopischen Nachweis der „Donovan bodies“ oder PCR aus Abstrich. Therapie: Wöchentlich Azithromycin 1 g bis zur Heilung.
M Pox (Human Monkeypox Virus, hMPXV) (40)
- Betroffene: Fast ausschliesslich MSM, die sich bei oder durch sexuelle Kontakte anstecken; wohl kann hMPXV auch durch Hautkontakt übertragen werden, aber das Risiko für die Bevölkerung ist gering. Die Inkubationszeit beträgt durchschnittlich 1 Woche (5-21 Tage)
- Die Hautläsionen sind meist anogenital oder perioral lokalisiert; meist sind es nur wenige Läsionen, z. T. nur eine. Das Exanthem beginnt oft makulupapulös, dann kommt es zu Bläschen, die aufplatzen und verkrusten. Oft sehen die Läsionen «atypisch» aus und es sind keine Bläschen (mehr) sichtbat. Die bei rund 50 % der Betroffenen auftretenden Allgemeinsymptome beginnen meist 1-4 Tage vor den Hautläsionen
- Verlauf: Meist verläuft die Erkrankung mild und unterscheidet sich klinisch von den Infektionen, die in den Endemiegebieten von hMPXV in Afrika auftreten und nicht mit sexuellen Kontakten assoziiert sind.
- Diagnostik: Erfolgt mittels PCR aus dem Abstrich einer Läsion. Gleichzeitig soll nach anderen STI gesucht werden. Die Infektionen werden den Kantonsärztlichen Diensten und dem BAG gemeldet (Arzt- und Labormeldung)
- Behandlung: Lokale Behandlung der Bläschen und Schmerztherapie. Bei schweren Verläufen kann mittels Compassionate Use Programmen eine systemische antivirale Therapie (Tecovirimat) eingesetzt werden
- Impfung: Die lebend abgeschwächte Pockenimpfung der 3. Generation (Imvanex®), indiziert für MSM mit wechselnden Partnern, bietet einen ca. 85 % Schutz gegen M Pox. Der Impfstoff ist im Rahmen von kantonalen Programmen in Impfzentren erhältlich.
12. Literatur
Übersichtsarbeiten und Partnernotifikation
- Arbeitsgruppe „Sexuell übertragbare Infektionen‟ im Auftrag des Bundesamtes für Gesundheit. Empfehlungen zur frühzeitigen Behandlung von sexuell übertragbaren Infektionen (STI) durch erstbehandelnde Ärztinnen und Ärzte: Klinisches Vorgehen bei Beschwerden im Genitalbereich. 2011.
- G-S Tiplica GS. 2015: European guidelines for the management of partners of persons with sexually transmitted infections. J Eur Acad Dermatol Venereol. 2015 Jul;29(7):1251-7. Doi: 10.1111/jdv.13181. Epub 2015 May 7.
- Workowski KA, Bolan GA: CDC Sexually transmitted infections treatment guidelines, 2021. Morbidity and Mortality Weekly Report. Recommendations and Reports. Vol. 70, No. 4 July 23, 2021.https://www.cdc.gov/std/treatment-guidelines/STI-Guidelines-2021.pdf.
- Schoepf IC et al.: Sexuell übertragbare Infektionen (Teil 1): Epidemiologie und Management. Primary and Hospital Care 2022;22(10): 313-317.
- Hunziker M et al.: Sexuell übertragbare Infektionen (Teil 2): Kommunikation, Urethritis, Genitalwarzen. Primary and Hospital Care 2022;22(11): 345-349.
- Schoepf IC et al., Sexuell übertragbare Infektionen (Teil 3): Chlamydien, Gonorrhoe, Syphilis. Primary and Hospital Care 2022;22(12): 36:-371.
Gonorrhö
- Guidelines der Schweizerischen Gesellschaft für Infektiologie: Gonorrhoe/Tripper (N. gonorrhoeae). Version 2022. https://ssi.guidelines.ch/guideline/2272.
- M Unemo, et al. 2020: European guideline for the diagnosis and treatment of gonorrhoea in adults. Int J STD AIDS 2020 Oct 29;956462420949126. doi: 10.1177/0956462420949126.
- Trellu LT, et al.: Gonorrhoe: neue Empfehlungen zu Diagnostik und Behandlung, Schweiz Med Forum 2014;14(20):407-409
- Nguyen PTT et al.: Randomized controlled trial of the relative efficacy of high-dose intravenous ceftriaxone and oral cefixime combined with doxycycline for the treatment of Chlamydia trachomatis and Neisseria gonorrhoeae co-infection. BMC Infect Dis. 2022 Jul 9;22(1):607. doi: 10.1186/s12879-022-07595-w
- de Vries HJC, et al.:Efficacy of ertapenem, gentamicin, fosfomycin, and ceftriaxone for the treatment of anogenital gonorrhoea (NABOGO): a randomised, non-inferiority trial. Lancet Infect Dis. 2022. PMID: 35065063 Clinical Trial.
Chlamydien-Infektion
- Sexuell übertragene Infektionen mit Chlamydia trachomatis: Empfehlungen der Eidgenössischen Kommission für Sexuelle Gesundheit (EKSG) und der Schweizerischen Gesellschaft für Infektiologie(SSI). BAG-Bulletin 35 vom 28. August 2017.
- Guidelines der Schweizerischen Gesellschaft für Infektiologie: Chlamydia (C. trachomatis) / LGV. Version 2021, https://ssi.guidelines.ch/guideline/2273.
- US Preventive Services Task Force. Screening for Chlamydia and Gonorrhea: US Preventive Services Task Force Recommendation Statement. JAMA. 2021 Sep 14;326(10):949-956. doi: 10.1001/jama.2021.14081.
- BASHH: UK national guideline for the management of infection with Chlamydia trachomatis 2015 (Update 2018). https://www.bashhguidelines.org/current-guidelines/urethritis-and-cervicitis/chlamydia-2015/.
- Lanjouw E, et al. 2015: European guideline on the management of Chlamydia trachomatis infections Int J STD AIDS. 2016 Apr;27(5):333-48. doi: 10.1177/0956462415618837. Epub 2015 Nov 24.
- Peuchant O, et al.:Doxycycline versus azithromycin for the treatment of anorectal Chlamydia trachomatis infection in women concurrent with vaginal infection (CHLAZIDOXY study): a multicentre, open-label, randomised, controlled, superiority trial. Lancet Infect Dis. 2022.PMID: 35550262 Clinical Trial.
Lymphogranuloma venereum
- Peuchant O, et al.: Prevalence of lymphogranuloma venereum among anorectal Chlamydia trachomatis-positive MSM using pre-exposure prophylaxis for HIV. Sex Transm Infect, 2020. 96(8): p. 615-617.
- Martinez-Garcia L, et al.: The silent epidemic of lymphogranuloma venereum inside the COVID-19 pandemic in Madrid, Spain, March 2020 to February 2021. Euro Surveill, 2021. 26(18).
- Cole MJ, et al.: Substantial underdiagnosis of lymphogranuloma venereum in men who have sex with men in Europe: preliminary findings from a multicentre surveillance pilot. Sex Transm Infect, 2020. 96(2): p. 137-142.
Syphilis
- Guidelines der Schweizerischen Gesellschaft für Infektiologie: Syphilis. Version 2021. https://ssi.guidelines.ch/guideline/2271.
- Itin P, et al.: Syphilis: Diagnostik und Behandlung. Aktualisierte Empfehlungen der Eidgenössischen Kommission für Sexuelle Gesundheit. SMF 2015;15(19):459–465.
- Janier M, et al. 2020: European guideline on the management of syphilis. J Eur Acad Dermatol Venereol. 2021 Mar;35(3):574-588. doi: 10.1111/jdv.16946. Epub 2020 Oct 22.
Trichomoniasis (T. vaginalis)
- Kissinger P, et al.: Single-dose versus 7-day-dose metronidazole for the treatment of trichomoniasis in women: an open-label, randomised controlled trial. Lancet Infect Dis 2018; 18: 1251–59.
- Muzny CA, et al.: The clinical spectrum of Trichomonas vaginalis infection and challenges to management. Sex Transm Infect 2013;89:423–425.
Mycoplasma sp.
- Soni S, et al.: British Association for Sexual Health and HIV national guideline for the management of infection with Mycoplasma genitalium (2018). Int J STD AIDS. 2019 Sep;30(10):938-950. doi: 10.1177/0956462419825948.
- Guidelines der Schweizerischen Gesellschaft für Infektiologie: Mycoplasma genitalium Infektion. https://ssi.guidelines.ch/guideline/3447.
- Jensen JS et al. 2021 European guideline on the management of Mycoplasma genitalium infections. J Eur Acad Dermatol Venereol. 2022 May;36(5):641-650. doi: 10.1111/jdv.17972. Epub 2022 Feb 19.
Ureaplasma sp.
- Horner P, et al.: Should we be testing for urogenital Mycoplasma hominis, Ureaplasma parvum and Ureaplasma urealyticum in men and women? - a position statement from the European STI Guidelines Editorial Board. J Eur Acad Dermatol Venereol. 2018 Nov;32(11):1845-1851.doi: 10.1111/jdv.15146.
Herpes genitalis
- Patel R, et al. 2017: European guidelines for the management of genital herpes. Int J STD AIDS. 2017 Dec;28(14):1366-1379. doi: 10.1177/0956462417727194.
- Surber J, et al. Folge 3: Infektionen in der Praxis. Genitalherpes – Update 2020 für die Praxis. Primary and Hospital Care 2020;20(3):100–104.
- Notter J, et al.: KSSG Guideline Genitaler Herpes. Guidelines HSV 1 & 2 06/2021.
Condyloma acuminata (Genitalwarzen)
Andere (Pilze, Ektoparasiten, „exotische“ STI), M Pox
- Kupsch C, et al.: Trichophyton mentagrophytes - a new genotype of zoophilic dermatophyte causes sexually transmitted infections. J Dtsch Dermatol Ges. 2019 May;17(5):493-501. doi: 10.1111/ddg.13776. Epub 2019 Feb 18.
- Luchsinger I, et al.: Tinea genitalis: a new entity of sexually transmitted infection? Case series and review of the literature. Sex Transm Infect. 2015 Nov;91(7):493-6. doi: 10.1136/sextrans-2015-052036. Epub 2015 Jun 12.
- Salavastru CM, et al.: European guideline for the management of pediculosis pubis. J Eur Acad Dermatol Venereol. 2017 Sep;31(9):1425-1428. doi: 10.1111/jdv.14420.
- Salavastru CM, et al.: European guideline for the management of scabies. J Eur Acad Dermatol Venereol. 2017 Aug;31(8):1248-1253. doi: 10.1111/jdv.14351.
- Lautenschlager S, et al. 2017: European guideline for the management of chancroid. Int J STD AIDS. 2017 Mar;28(4):324-329. doi: 10.1177/0956462416687913.
- O'Farrell N, et al. 2016: European guideline on donovanosis. Int J STD AIDS. 2016 Jul;27(8):605-7. doi: 10.1177/0956462416633626.
- Simon NR et al. Affenpocken. Primary and Hospital Care 2022;22(10)
Weitere Links
- Schweizerische Gesellschaft für Infektiologie: https://ssi.guidelines.ch/
- International Union against Sexually Transmitted Infections: Current European Guidelines
- British Association for Sexual Health and HIV: http://www.bashh.org
13. Impressum
Diese Guideline wurde im März 2022 aktualisiert.
© Verein mediX schweiz
Herausgeber
Prof. Dr. med. Corinne Chmiel
Redaktion
Prof. Dr. med. Corinne Chmiel
Dr. med. Felix Huber
Dr. med. Uwe Beise
Dr. med. Maria Huber
Autoren
Prof. em. Dr. med. Rainer Weber
Rückmeldungen bitte an:
Diese Guideline wurde ohne externe Einflussnahme erstellt. Es bestehen keine finanziellen oder inhaltlichen Abhängigkeiten gegenüber der Industrie oder anderen Einrichtungen oder Interessengruppen.
mediX Guidelines enthalten therapeutische Handlungsempfehlungen für bestimmte Beschwerdebilder oder Behandlungssituationen. Jeder Patient muss jedoch nach seinen individuellen Gegebenheiten behandelt werden.
mediX Guidelines werden mit grosser Sorgfalt entwickelt und geprüft, dennoch kann der Verein mediX schweiz für die Richtigkeit – insbesondere von Dosierungsangaben – keine Gewähr übernehmen.
Der Verein mediX schweiz ist ein Zusammenschluss von Ärztenetzen und Ärzten in der Schweiz
Verein mediX schweiz, Sumatrastr. 10, 8006 Zürich.