Guideline
Eisenmangel
Zuletzt revidiert: 07/2022 Letzte Änderung: 05/2023
- Guideline Kurzversion
- Patienteninformation Eiseninfusion
- Intravenöse Eiseninfusion, Merkblatt MPA

Aktualisierung 05/2023
- Bei Eisenmangel ohne Anämie und Ferritin-Ausgangswerten von > 15 ng/ml ist eine Eisensubstitution nicht indiziert (–> Kap. 4.2.)
- Intravenöse Eisentherapie: Das praktische Vorgehen bei Auftreten von Nebenwirkungen wurde ergänzt (–> Kap. 4.2.)
- Ergänzende Informationen zu Eisenmangel bei verschiedenen chronischen Komorbiditäten (Kapitel 4.2.).
1. Definition, Epidemiologie, Stadien
Definition
- Eisenmangel ist definiert als Verminderung des Gesamtkörpereisens. Eine Eisenmangelanämie liegt vor, wenn die Hämoglobinkonzentration eisenmangelbedingt unter den alters-, bzw. geschlechtsspezifischen Normwert absinkt, gemäss WHO bei Frauen < 12 g/dl, bei Männern < 13 g/dl.
Epidemiologie
- 80 % aller Anämien sind Eisenmangelanämien, in 80 % sind Frauen (Menstruation, Gravidität) betroffen
- Studien aus Europa und USA: 15–20 % aller Frauen im Menstruationsalter haben Eisenmangel ohne Anämie (Ferritin-Grenzwert: < 15 ng/ml), ca. 3 % haben eine manifeste Eisenmangelanämie (1, 2). Bei Schwangeren ist Eisenmangel häufiger als bei Nicht-Schwangeren
- Eisenstatus-Studie bei jungen Frauen (ZH): 22,7 % Eisenmangel (Ferritin-Grenzwert: < 15 ng/ml), 2,2 % Eisenmangelanämie (4).
Stadien des Eisenmangels
In Abhängigkeit vom Schweregrad werden 3 Stadien unterschieden (5, 6)
Stadium 1: Nichtanämischer Eisenmangel
- Hb und MCV normal, Ferritin verringert; ohne Effekt auf die Hämatopoese.
Stadium 2: Eisendefizitäre Erythropoese
- Hb normal, Ferritin verringert (Grenzwerte variieren), Hämatopoese und eisenabhängige Stoffwechselvorgänge können – je nach Komorbiditäten – beeinträchtigt sein.
Stadium 3: Eisenmangelanämie (hypochrome, mikrozytäre Anämie)
- Hb < 12 g/dl (Frauen) bzw. < 13 g/dl (Männer), MCV, MCH und Erythrozytenzahl verringert.
Beachte: Hb sinkt oft schneller als die Ery-Zahl. Selbst bei deutlich unterschrittenem Hb kann die Ery-Zahl noch im unteren Normbereich liegen.
Ursachen
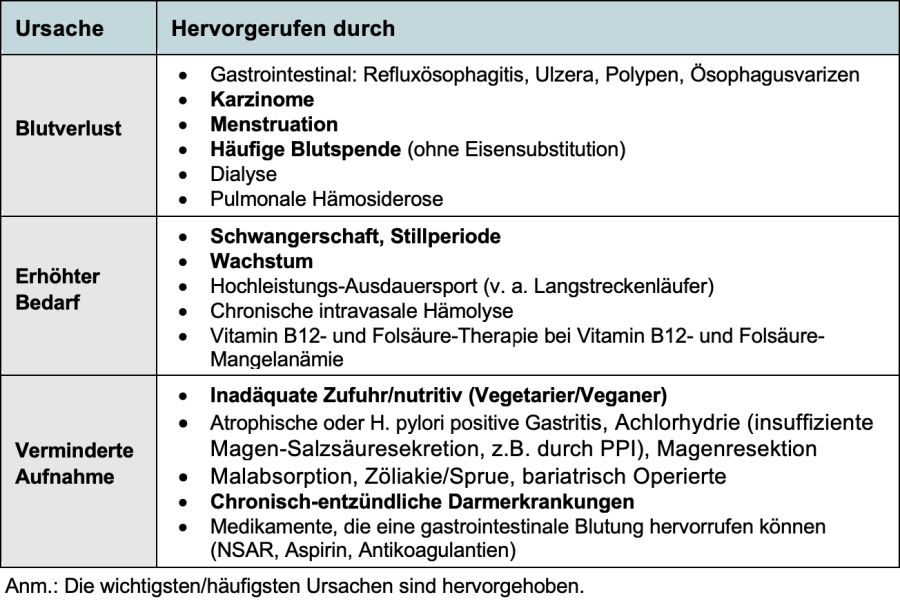
Eisenmangel entsteht zumeist durch einen vermehrten Eisenverlust oder erhöhten Eisenbedarf, seltener durch Resorptionsstörungen. Mögliche Ursachen sind in Tabelle 1 dargestellt.
Tabelle 1: Ursachen von Eisenmangelanämie
Symptome
Das Auftreten der Symptome hängt von der Dauer und Schwere des Eisenmangels ab.
- Allgemeine Zeichen (Auftreten in Abhängigkeit von Schwere und Dauer)
- Muskuläre Schwäche und herabgesetzte Ausdauerleistung, Müdigkeit, Reizbarkeit, Vertigo
- Kognitive Störungen (Konzentrationsschwäche, beeinträchtigte Lernfähigkeit, Gedächtnisstörung)
- Kopfschmerzen, Belastungsdyspnoe, Tachykardie, reduzierte Thermoregulation, Appetit auf Lehm und Erde.
- Haut- und Schleimhäute
- Blässe (unsicheres Zeichen) der Haut und Schleimhäute (speziell Konjunktiven, verlässlicheres Zeichen)
- Rillenbildung der Nägel, brüchige Nägel, Haarausfall, trockene Haut, Pruritus, Aphthen, Mundwinkelrhagaden.
Anmerkungen zu Müdigkeit und Anämie
- Es gibt bevölkerungsweit keine Beziehung zwischen „isolierter“ Müdigkeit und Anämie (8–10). Andererseits: Bei prämenopausalen Frauen mit Eisenmangel ohne Anämie kann Müdigkeit durch Eisentherapie gelindert/behoben werden (11) – jedoch signifikant nur bei Ferritin < 15 ng/ml (11, 12). Zur Therapie von Eisenmangel ohne Anämie siehe Kap. 4.2.
- Bei ungeklärter Müdigkeit vor Eisen-Therapie auch an andere auslösende Krankheiten denken, z. B. Depression, Hypo-/Hyperthyreose, Niereninsuffizienz, Diabetes mellitus, Hyperparathyreoidismus, chronische Hepatitis etc. (13). Siehe auch mediX GL Müdigkeit.
3. Diagnose
3.1. Labordiagnostik
Folgende Parameter sind notwendig: Hämatogramm, Serum-Ferritin, CRP (15).
Eisenmangelanämie
- Hb < 12 g/dl (Frauen), < 13 g/dl (Männer); leichte Anämie: Hb 9–12 g/dl, schwere Anämie: 6–7 g/dl
- Ferritin (Grenzwerte teilweise umstritten)
⇒ Von einem Eisenmangel kann ausgegangen werden bei einem Serum-Ferritin < 15 ng/ml, mit entsprechenden Symptomen (15, 20, 21). Bei Patienten mit einigen chronischen Erkrankungen gelten abweichende Grenzwerte (s. u. Abschnitt „Screening“)
- Bei hämatologischen und onkologischen Patienten kann ergänzend zum Ferritin (oft „entzündlich“ erhöhte Werte) die Transferrinsättigung bestimmt werden. Eine verringerte Transferrinsättigung bedeutet, dass der Erythropoese zu wenig Eisen zur Verfügung steht. Dies kann bei erhöhten Entzündungswerten auch dann der Fall sein, wenn die Eisenspeicher gut gefüllt sind.
⇒ Eine Transferrinsättigung (TSAT) ≤ 20 % gilt als diagnostisch für einen Eisenmangel – auch bei Neoplasien, Herzinsuffizienz und chronischer Niereninsuffizienz (15, 22).
Anmerkung: Serum-Eisen ist als diagnostischer Parameter eines Eisenmangels obsolet.
Differentialdiagnose
Eine hypochrome mikrozytäre Anämie kann auch bei leichten Formen von hereditären Anämien wie Alpha- oder Beta-Thalassämie oder bei chronischen Erkrankungen vorliegen.
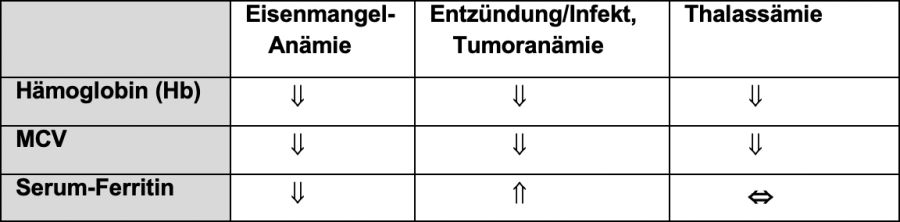
Beachte: Entzündungs-, Infekt- und Tumoranämie sind häufig normochrom, Eisenmangel in Kombination mit B12-Mangel kann normozytär sein!
3.2. Ursachenabklärung
Eisenmangel(anämie) stellt lediglich ein Symptom dar und sollte zunächst in seiner Ätiologie geklärt werden
- Nutritiv (Vegetarier/Veganer)?
- Blutspender?
- Hypermenorrhoe?
- Einnahme von Aspirin®, NSAR, Marcoumar® (chronische gastrointestinale Blutung)?
- Oligosymptomatische Sprue mit gastrointestinalen Symptomen (Gewichtsverlust, Durchfall, Bauchschmerzen)? –> Abklären mit Tissue-Transglutaminase-IgA und Gesamt-IgA.
Ohne klare anamnestische Hinweise sollten vordringlich maligne und chronisch entzündliche Erkrankungen des Magen-Darm-Trakts ausgeschlossen werden. Wenn kein konkreter Verdacht vorliegt, Abklärung in Abhängigkeit vom Alter
- Patienten < 50 J.: Zuerst Gastroskopie mit Dünndarmbiopsie (Frage nach Sprue), wenn ohne Befund –> anschliessend Koloskopie
- Patienten > 50 J.: Zuerst OC Sensor oder Koloskopie, wenn ohne Befund –> anschliessend Gastroskopie.
Screening
- Es wird kein generelles Screening auf Eisenmangel empfohlen, ohne dass entsprechende Symptome beschrieben werden
- Patienten mit Herzinsuffizienz weisen häufig (ca. 55 % bei chronischer Herzinsuffizienz) begleitend eine Anämie auf. Diese Patienten sollten deshalb jährlich auf eine Eisenmangelanämie untersucht werden. Ein Eisendefizit liegt laut ESC Guideline 2021 bei einem Serumferritin < 100 ng/ml
- Patienten mit chronischer Entzündungsanämie (Erys hypo- bis normochrom, Transferrinsättigung < 20 %, Entzündungsparameter [+]), z. B. chronisch-entzündliche Darmkrankheiten, sollten regelmässig auf Eisenmangel untersucht werden (über genaue Screening-Intervalle gibt es keine allgemeinen Empfehlungen). Bei einem Serumferritin < 30 ng/ml ist von einem therapiebedürftigen absoluten Eisenmangel auszugehen
- Bei chronischer Niereninsuffizienz soll gemäss nephrologischen Empfehlungen periodisch auf Eisenmangel untersucht werden (28). Bei Patienten ohne Anämie und eGFR ≥ 45 ml/min/1,73 m2 jährlich, bei eGFR
< 45 ml/min/1,73 m2 mindestens 2 x/Jahr. Bei Patienten mit Anämie (aber ohne Erythropoetin-stimulierende Medikamente): Bei leichter Anämie und eGFR
≥ 45–60 ml/min/1,73 m2 alle 6 Monate, bei rasch progredienter Erkrankung, schwerer Anämie und eGFR < 45 ml/min/1,73 m2 alle 3 Monate. Grenzwerte vom Eisen je nach Grad der Niereninsuffizienz sind von geringer Evidenz.
4. Therapie
4.1. Ernährung
Die Eisenzufuhr kann durch eine eisenreiche Ernährung erhöht und damit einem Eisenmangel vorgebeugt werden. Bei bestehendem Eisenmangel muss in der Regel zusätzlich medikamentös substituiert werden.
- Eisenbedarf
- Aufnahme mit Nahrung pro Tag

- Aufnahme mit Nahrung pro Tag
- Ernährung
- Tierisches Eisen liegt etwa zu 40–90 % als gut absorbierbares zweiwertiges Hämeisen (Myoglobin, Hämoglobin, Cytochrome) vor, das über einen eigenen Transporter wesentlich effektiver aufgenommen werden kann als das Non-Häm-Eisen anderer Lebensmittel. „Gemüse-Eisen“ liegt in dreiwertiger Form vor und kann erst nach Reduktion zu Fe2+ resorbiert werden.
- Fe3+ ist bei einem pH > 3 nicht absorbierbar. Es braucht zur Resorbierbarkeit Magensäure und/oder Ascorbinsäure (Cave: Therapie mit PPI)
- Das Nicht-Hämeisen (freies Eisen) kann in der Resorption gefördert oder gehemmt werden
- Resorption wird gefördert durch
- Gegärte Lebensmittel (tiefer pH), z.B. Sauerkraut
- Organische Säuren (Zitrus- und andere Früchte, Fruchtsäfte zu den Mahlzeiten).
Hinweis: Entgegen früheren Annahmen hat Vitamin C offenbar keinen nennenswerten Einfluss auf die Eisenresorption (24).
- Resorption wird gehemmt durch
- Phytate: Z. B. Kleie (Substanz in der äusseren Hülle des Korns. Bindet eine Reihe von Nährstoffen im Darm wie Eisen, Zink, Calcium oder Magnesium, die dann unverdaut ausgeschieden werden)
- Oxalat (Spinat)
- Polyphenolverbindungen (Schwarztee, Kaffee, Kräutertee, Kakao, Rotwein, Oregano)
- Calcium (Milch): Unterschiedliche Angaben zum Stellenwert der Eisenaufnahmehemmung.
- Resorption wird gefördert durch
- Gute Eisenlieferanten sind (umfangreiche Tabelle zum Eisengehalt von Nahrungsmitteln in iron.medline)
- Fleisch (rotes Muskelfleisch hat am meisten verwertbares Eisen), Leber
- Hülsenfrüchte (Sojabohnen, Linsen, Kichererbsen)
- Nüsse und Samen (Pistazien, Mandeln, Haselnüsse, Sonnenblumenkerne, Leinsamen)
- Getreideprodukte (v. a. Vollkorn)
- Gemüse und Kräuter (Petersilie, Brunnenkresse, Löwenzahn, Zwiebeln, Schwarzwurzel)
- Gusseisernes Kochgeschirr erhöht den Eisengehalt der Speisen.
4.2. Eisensubstitution
Indikation
- Jede Eisenmangelanämie ist eine Indikation zur Eisensubstitution
- Eine plazebokontrollierte Studie (2020) bei Blutspendern mit Eisendefizit, aber ohne Anämie, ergab, dass i.v. Eisensupplementation weder Müdigkeit noch andere Symptome beeinflusste, wie etwa eingeschränkte Lebensqualität, eingeschränkte Arbeitsleistung, kognitive Einschränkungen, Stimmungsschwankungen und „restless legs“ (20). Es ist also fraglich, ob ein Eisenmangel ohne Anämie überhaupt behandelt werden soll
- Bei Eisenmangel ohne Anämie und Ferritin-Ausgangswerten von > 15 ng/ml ist eine Eisensubstitution nicht indiziert (5, 6, 15, 16, 20). Deren Nutzen ist nicht ausreichend belegt. Das gilt auch für Patienten mit Restless-legs-Syndrom (14, 20) –> siehe auch mediX GL Schlafstörungen (Kap.5)
- Bei Eisenmangel ohne Anämie und Ferritinwerten < 15 ng/ml kann im Einzelfall eine Eisensubstitution erwogen werden, auch wenn der Nutzen fraglich ist
- Eine Eisen-Substitution bei gefülltem Eisenspeicher (normales Ferritin) ist nicht indiziert und potenziell schädlich (6, 25)
Eisensubstitution bei Komorbiditäten
- Herzinsuffizienz: Bei symptomatischen Patienten mit LVEF < 45 % und Eisenmangel (definiert als Serumferritin < 100 ng/ml) empfiehlt die ESC Guideline 2021 eine intravenöse Eisentherapie mit Eisencarboxymaltose (z. B. Eisencarboxymaltose Sandoz®). Die AFFIRM-HF-Studie (2020) hat ergeben, dass eine Eisentherapie bei diesen Patienten das Risiko von Hospitalisationen verringert. Der definierte primäre Studienendpunkt – die Kombination aus kardiovaskulärem Tod und Rehospitalisierung aufgrund einer Herzinsuffizienz – verfehlte die statistische Signifikanz jedoch. Siehe auch mediX GL Herzinsuffizienz (Kap. 4, Abschnitt Eisensubstitution)
- Chronisch-entzündliche Darmkrankheiten (CED): Bei CED-Patienten mit Entzündungsanämie und Serumferritinwerten < 30 μg/l sollte Eisen substituiert werden (27). Der Nutzen einer Eisentherapie bei CED-Patienten mit Eisendefizit ohne Anämie wird kontrovers diskutiert und ist bislang nicht gesichert (–> ECCO Guideline/Konsensus)
Bei Therapiebedarf: Orale und intravenöse Eisentherapie sind möglich, die Entscheidung erfolgt individuell. Intravenöse Eisentherapie ist sinnvoll bei ausgeprägter akuter Entzündungsreaktion, nicht adäquatem Hb-Anstieg unter oraler Eisentherapie und bei tiefen Hb-Werten mit schnell erwünschtem Hb-Anstieg (–> Universimed) - Renale Anämie –> siehe mediX GL Chronische Niereninsuffizienz (Kap. 3.5). Grenzwerte für eine Therapie sind von geringer Evidenz
- Schwangere: Unterer Hb-Grenzwert < 11 g/dl (im 2. Trimester < 10,5 g/dl); Serum-Ferritin < 30 ng/ml ist in der Schwangerschaft eine Behandlungsindikation, auch wenn (noch) keine Anämie besteht (19). Begründung: Erhöhter Eisenbedarf in der Schwangerschaft, zu erwartender Blutverlust unter der Geburt und erhöhter Bedarf beim Stillen
Dosierung und Applikation

Faustregel zur notwendigen Eisendosis entsprechend Ausgangs-Ferritin-Wert (5):
Serum-Ferritin
- < 10 ng/ml –> kumulative Gesamtdosis von 1’000 mg Eisen
- 10–30 ng/ml –> kumulative Gesamtdosis von 500 mg Eisen
- 30–50 ng/ml –> eine Dosis von 200 mg Eisen.
Hinweis: Bei Vorliegen einer Eisenmangelanämie sollte der Eisenbedarf berechnet werden, ansonsten ist es ausreichend, sich an der Faustregel zu orientieren.
1. Orale Eisensubstitution ist weiterhin die Standardapplikation
Dosierung
- Bei Erwachsenen 100–150 mg jeden zweiten Tag (bessere Fe-Resorption als bei täglicher Einnahme [17]). Einnahme mindestens 30 min vor Nahrungsaufnahme (bei magenempfindlichen Patienten während/nach dem Essen, dann aber etwas schlechtere Resorption)
- Bei Hochbetagten (≥ 80 J.) kann auch eine Niedrigdosis gewählt werden (16). In einer einschlägigen Studie erwies sich eine Tagesdosis von 15 mg Eisen so wirksam wie Vergleichsdosierungen von 50 mg und 150 mg, jedoch deutlich verträglicher (18)
- Bei Frauen mit Kinderwunsch ist eine zusätzliche Folsäuresubstitution empfehlenswert.
Medikamente
- Fe2+: Tardyferon®, Ferrum Hausmann®
- Fe3+: Einzige orale Form Maltofer® (etwas besser verträglich als Fe2+, aber etwas schlechtere Resorption)
Nebenwirkungen: Gastrische NW (Nausea) oder Obstipation limitieren die Therapie relativ häufig –> Reduktion der Eisendosis, ev. Wechsel auf Tropfenform kann NW mildern.
Kontraindikationen: Anämien mit normalen Ferritinspiegeln, Hämosiderose und Hämochromatose mit erhöhten Ferritinspiegeln.
2. Intravenöse Eisensubstitution kann sinnvoll sein, wenn orales Eisen nicht vertragen oder ungenügend resorbiert wird, sowie bei Schwangeren, bei chronisch-entzündlichen Darmerkrankungen oder chronischer Nierenerkrankung (16)
- Mit 100 mg Eisen kann das Ferritin um ca. 10 ng/ml angehoben werden. Unbedingt streng intravenös verabreichen (Venflon verwenden)!
- Eisencarboxymaltose Sandoz® als Kurzinfusion (verdünnt in physiologischer Kochsalzlösung) verabreichen: 500–1‘000 mg in 250 ml NaCl 0,9 % und minimale Infusionszeit 15 min. Dosierung: 20 mg Eisen/kgKG. Bei einer erstmaligen Eiseninfusion sollten 500 mg nicht überschritten werden. Bei bekannter guter Verträglichkeit können im Verlauf, wenn der Bedarf hoch ist, jeweils 1‘000 mg verabreicht werden. Alternativ zu Eisencarboxymaltose kann – bei vergleichbarer Wirksamkeit und Verträglichkeit – auch Monofer® (Eisenmaltosoid) verbreicht werden. Dosierung Monofer®: Max. Tagesdosis von 20 mg/kgKG (Infusionszeit mind. 15 min bei Dosen bis zu 1‘000 mg, bei Dosen > 1‘000 mg beträgt die Infusionszeit 30 min oder länger)
- Monofer® benötigt keine Testdosis. Kosten: Im Vergleich mit Ferinject® etwas kostengünstiger (Preisdifferenz CHF 5.– bzw. CHF 12.– für 500 mg bzw. 1‘000 mg)
- Die wöchentliche Maximaldosis von 1‘000 mg Eisen bzw. 20 mg Eisen/kgKG darf nicht überschritten werden! Einzelheiten in: Merkblatt Eiseninfusion (Beispiel Feinject®). Für Monofer®gibt es keine 1‘000 mg-Dosislimite
- Eiseninfusionen in der Schwangerschaft: Erst ab dem 2. Trimenon.
Nebenwirkungen
- Schwere anaphylaktische Reaktionen sind extrem selten (< 1:1‘200‘000 Dosen), jedoch massiv, wenn sie auftreten (26). Transiente Infusions-assoziierte nicht-allergische Reaktionen sind Flush-Symptomatik, Herzklopfen, Unwohlsein, Schwindel, Myalgien und Fieber (bei 0,5–1 % der Infusionen). Wiederholte Eiseninfusionen können zu Eisenüberladung und deren Komplikationen führen
- Bei Patienten mit Niereninsuffizienz unter Behandlung mit Erythropoese-stimulierenden Substanzen soll auf weitere Eiseninfusionen verzichtet werden, wenn die Transferrin-Sättigung > 30 % oder das Ferritin > 500 ng/ml liegt (23)
- Nach Eiseninfusionen kann es zu meist passageren, in Einzelfällen schweren Hypophosphatämien kommen (29–31).
Anmerkungen:
Unter Ferinject sind Hypophosphatämien häufiger und ausgeprägter als unter Monofer. Die klinische Relevanz dieser Laborbefunde ist aber bislang unklar. In keiner der Studien korrelierten relevante klinische Befunde eindeutig mit dem gemessenen Phosphatspiegel (30, 31).
⇒ mediX empfiehlt
- Keine routinemässige Phosphatmessung vor Eiseninfusion
- Bei Patienten, die nach Eiseninfusion eine stärkere Fatigue und generelle Müdigkeit aufweisen als vor der Infusion, oder Atembeschwerden und gastrointestinale Nebenwirkungen aufzeigen, kann dies auf eine klinisch relevante Hypophosphatämie hindeuten. In diesen Fällen wird empfohlen, Phosphat im Plasma zu messen
- Ist eine weitere Eiseninfusion geplant, empfiehlt mediX eine vorgängige Messung des Phosphats, um eine Entscheidungshilfe zu bieten, welches Präparat für die Eiseninfusion gewählt werden soll.
Vorgehen bei Nebenwirkungen
Notfallmassnahmen bei schweren (anaphylaktischen) Reaktionen (–> mediX Notfallplan)
Bei weniger schweren Reaktionen (ohne Hypotonie, Tachykardie, Tachypnoe, Stridor, periorbitales Ödem)
- Anhalten der Infusion und Beobachten des Patienten (ohne Verabreichen irgendeiner Medikation)
- Bilden sich die Symptome zurück, Infusion fortsetzen (= häufigster Verlauf)
- Verschlechtern sich die Symptome –> wie schwere Reaktion behandeln
- Bleiben die Symptome bestehen, Applikation von Methylprednison i.v., 30 Minuten warten und Infusion neu einleiten.
Was tun bei Allergie auf i.v. Eisenpräparat und erneut benötigter Eiseninfusion?
⇒ Anderes Präparat versuchen (s. a. Abschnitt „Intravenöse Eisenpräparate“ in Universimed)
oder
⇒ Vorbehandlung mit Prednisolon und Antiallergikum unter erhöhter Überwachungsbereitschaft (am besten im Spital-Setting).
4.3. Therapiekontrolle
⇒ Über die Dauer der Eisensubstitution herrscht keine Einigkeit.
- Bei nichtanämischem symptomatischem Eisenmangel kann die Dauer der Substitution auf der Basis des Ferritins und der Befindlichkeit festgelegt werden
- Beim anämisierenden Eisenmangel sollen mit der Eisensubstitution auch die Eisenspeicher aufgefüllt werden (Serum-Ferritin: 50–100 ng/ml).
Kontrollen bei Eisenmangelanämie (6)
- Hämoglobin nach 4 Wochen (sollte um ca. 2 g/dl angestiegen sein)
- Weitere Hb-Kontrollen: Alle 4 Wochen bis zur Normalisierung des Hb-Wertes
- Ferritin-Messung: 6–8 Wochen nach der letzten Eiseneinnahme zur Kontrolle der Eisenspeicher, bei i.v. Eisentherapie nach 12 Wochen.
5. Literatur
- Looker AC, et al.: Iron deficiency – United States, 1999–2000. Morb Mortal Wkly Rep. 2002;51:897–99.
- Galan P, et al.: Determinig factors in the iron status of adult women in the SU.VI.MAX.study. Eur J Clin Nutr. 1998;52:383–8.
- Schleiffenbaum BE, et al.: Unexpected high prevalence of metabolic disorders and chronic disease among young male draftees – the Swiss Army XXI experience. Swiss Med Wkly 2006; 18: 175–184.
- Sempach JS: Ernährungsgewohnheiten und Nährstoffstatus von jungen Frauen in Zürich (Dietary patterns and nutrient intake in young women in Zürich). PhD thesis. Zurich: Swiss Federal Institute of Technology Zürich, 1995: 1–144.
- Clénin G, et al.: Consensus statement of the Swiss Society of Sports Medicine. Iron deficiency in sports – definition, influence on performance and therapy. Swiss Med Wkly. 2015;145:w1419 Swiss Medical Weekly, 2015.
- Clénin G: The treatment of iron deficiency without anaemia (in otherwise healthy persons). Swiss Med Wkly. 2017;147:w14434 Swiss Medical Weekly, 2017.
- Masche U.P: Eisentherapie. Pharma-kritik, Ausgabe 17/2006.
- Wood MM, Elwood PC: Symptoms of iron deficiency anaemia. A Community survey. Brit J Prev Soc Med 1966; 20: 117.
- Elwood PC, Waet, et al.: Symptoms and circulating haemoglobin level. J Chron Dis 1969; 21: 615-28.
- Knottnerus JA, Knipet, et al.: Unexplained Fatigue and Hemoglobin: A Primary Care Study. Can Fam Physican 1986; 32: 1601-4.
- Krayenbühl P-A, Battegay E, et al.: Intravenous iron for the treatment of fatigue in nonanemic, premenopausal women with low serum ferritin concentration. Blood. 2011;118(12):3222-3227.
- Von Drygalski A, Adamson JW: Ironing out fatigue. Blood 2011;118(12):3191–2.
- Martius F: Eisenmangel ohne Anämie. Nicht hämatologische Auswirkungen des Eisenmangels: Welche sind belegt, wann kommen sie zum Tragen? Schweiz Med Forum 2009; 9(15-16):294-299.
- Trotti LM, Bhadriraju S, Becker LA: Iron for restless legs syndrome. Cochrane Database of Systematic Reviews 2019, https://doi.org/10.1002/14651858.CD007834.pub3
- Schrier SL: Causes and diagnosis of iron deficiency and iron deficiency anemia in adults. UpToDate, aufgerufen 06/2022.
- Schrier SL, Auerbach M: Treatment of iron deficiency anemia in adults UpToDate, aufgerufen 06/2022.
- Stoffel NU, et al.: Iron absorption from oral iron supplements given on consecutive versus alternate days and as single morning doses versus twice-daily split dosing in iron-depleted women: two open-label, randomised controlled trials. Lancet Haematol. 2017;4(11):e524. Epub 2017 Oct 9.
- Rimon E, et al.: Are we giving too much iron? Low-dose iron therapy is effective in octogenarians. Am J Med.2005 Oct;118(10):1142-7.
- Schweizerische Gesellschaft für Gynäkologie und Geburtshilfe (SGGG): Diagnostik und Therapie der Eisenmangelanämie in der Schwangerschaft und postpartal. SGGG, 1/2017.
- Keller P, et al.: The effects of intravenous iron supplementation on fatigue and general health in non-anemic blood donors with iron deficiency: a randomized placebo-controlled superiority trial. Sci Rep 10, 14219 (2020). https://doi.org/10.1038/s41598-020-71048-0.
- Garcia-Casal MN, et al.: Serum and plasma ferritin as an index of iron deficiency and overload. Cochrane Database of Systemic Reviews 2021, Issue 5.
- Gattermann N, Muckenthaler M, Kulozik AE, Metzgeroth G, Hastka J: The evaluation of iron deficiency and iron overload. Dtsch Arztebl Int 2021; 118: 847–56. DOI: 10.3238/arztebl.m2021.0290.
- Tichelli A: Gegenwärtiger Stand der intravenösen Eisentherapie. Sept. 2019.
- Li N, et al.: The Efficacy and Safety of Vitamin C for Iron Supplementation in Adult Patients With Iron Deficiency Anemia: A Randomized Clinical Trial. JAMA Netw Open. 2020;3(11):e2023644. Epub 2020 Nov 2.
- Shah AA, et al.: Risk of Infection Associated With Administration of Intravenous IronA Systematic Review and Meta-analysis. JAMA Netw Open. 2021;4(11):e21sued33935.
- Dave CV, et al.: Risks for anaphylaxis with intravenous iron formulations. A retrospective cohort study. Ann Intern Med. 29 March 2022 https://doi.org/10.7326/M21-4009.
- Resál T, Farkas K and Molnár T (2021): Iron Deficiency Anemia in Inflammatory Bowel Disease: What Do We Know? Front. Med. 8:686778.
- Berns JS: Treatment of anemia in nondialysis chronic kidney disease. UpToDate, aufgerufen 06/2022.
- Schaefer B, Tobiasch M, Viveiros A, et al.: Hypophosphataemia after treatment of iron deficiency with intravenous ferric carboxymaltose or iron isomaltoside—a systematic review and meta-analysis. Br J Clin Pharmacol. 2021; 87: 2256–2273. https://doi.org/10.1111/bcp.14643.
- Fragkos KC, Sehgal V, Rogers J, et al.: Hypophosphataemia after intravenous iron therapy with ferric carboxymaltose—Real world experience from a tertiary centre in the UK. GastroHep. 2020; 2: 205– 214. https://doi.org/10.1002/ygh2.415.
- Zoller H, Wolf M, et al.: Hypophosphataemia following ferric derisomaltose and ferric carboxymaltose in patients with iron deficiency anaemia due to inflammatory bowel disease (PHOSPHARE-IBD): a randomised clinical trial. Gut. 2023 Apr;72(4):644-653. doi: 10.1136/gutjnl-2022-327897. Epub 2022 Sep 9. PMID: 36343979; PMCID: PMC10086283.
6. Impressum
Diese Guideline wurde im Juli 2022 aktualisiert. Letzte Änderung: Mai 2023
© Verein mediX schweiz
Herausgeberin
Prof. Dr. med. Corinne Chmiel
Redaktion
Prof. Dr. med. Corinne Chmiel
Dr. med. Uwe Beise
Dr. med. Felix Huber
Dr. med. Maria Huber
Autoren
Prof. Dr. med. Corinne Chmiel
Dr. med. Uwe Beise
Diese Guideline wurde ohne externe Einflussnahme unter Mitarbeit aller regionalen mediX Ärztenetze und assozierter Ärztenetze in der Schweiz erstellt. Es bestehen keine finanziellen oder inhaltlichen Abhängigkeiten gegenüber der Industrie oder anderen Einrichtungen oder Interessengruppen.
mediX Guidelines enthalten therapeutische Handlungsempfehlungen für bestimmte Beschwerdebilder oder Behandlungssituationen. Jeder Patient muss jedoch nach seinen individuellen Gegebenheiten behandelt werden.
mediX Guidelines werden mit grosser Sorgfalt entwickelt und geprüft, dennoch kann der Verein mediX schweiz für die Richtigkeit – insbesondere von Dosierungsangaben – keine Gewähr übernehmen.
Alle mediX Guidelines im Internet unter www.medix.ch
Der Verein mediX schweiz ist ein Zusammenschluss von Ärztenetzen und Ärzten in der Schweiz
Verein mediX schweiz, Sumatrastr.10, 8006 Zürich
Rückmeldungen bitte an: