Guideline
Carence en fer
Dernière révision: 07/2022 Dernière modification: 05/2023
- Information aux patients Perfusion de fer
1. Définition, épidémiologie, stades
Définition
- La carence en fer est définie comme une diminution de la quantité totale de fer dans l'organisme. On parle d'anémie ferriprive lorsque la concentration d'hémoglobine due à la carence en fer tombe en dessous de la norme spécifique à l'âge ou au sexe, selon l'OMS < 12 g/dl chez les femmes et < 13 g/dl chez les hommes.
Epidémiologie
- Environ 80 % de toutes les anémies sont des anémies de carence en fer, et dans 80 % des cas cela concerne les femmes (menstruation, grossesse)
- Etudes menées en Europe et aux Etats-Unis: 15–20 % de toutes les femmes en âge d'avoir des règles présentent une carence en fer sans anémie (valeur limite de la ferritine: < 15 ng/ml), environ 3 % ont une anémie ferriprive manifeste (1, 2). La carence en fer est plus fréquente chez les femmes enceintes que chez les femmes non enceintes
- Etude sur le statut du fer chez les jeunes femmes (ZH): 22,7 % de carence en fer (valeur limite de la ferritine: < 15 ng/ml), 2,2 % d'anémie ferriprive (4).
Stades de la carence en fer
En fonction du degré de gravité, on distingue 3 stades (5, 6)
Stade 1: carence en fer non anémique
- Hb et VGM normaux, ferritine diminuée; sans effet sur l'hématopoïèse.
Stade 2: érytropoïèse déficitaire en fer
- Hb normale, ferritine diminuée (les valeurs limites varient), l'hématopoïèse et les processus métaboliques peuvent être affectés en fonction des comorbidités.
Stade 3: anémie ferriprive (anémie hypochrome, microcytaire)
- Hb < 12 g/dl (femmes) ou < 13 g/dl (hommes), VGM, TGM et nombre d'érythrocytes réduits.
A noter: souvent, l'Hb diminue plus rapidement que le nombre d'érythrocytes. Même si le taux d'Hb est nettement inférieure à la normale, le nombre d'érythrocytes peut encore se situer dans la partie inférieure de la norme.
2. Causes et symptômes
Causes
La carence en fer résulte le plus souvent d'une perte accrue de fer ou d'un besoin accru en fer, plus rarement de troubles de l'absorption. Les causes possibles sont présentées dans le tableau 1.
Tableau 1: causes de l'anémie ferriprive
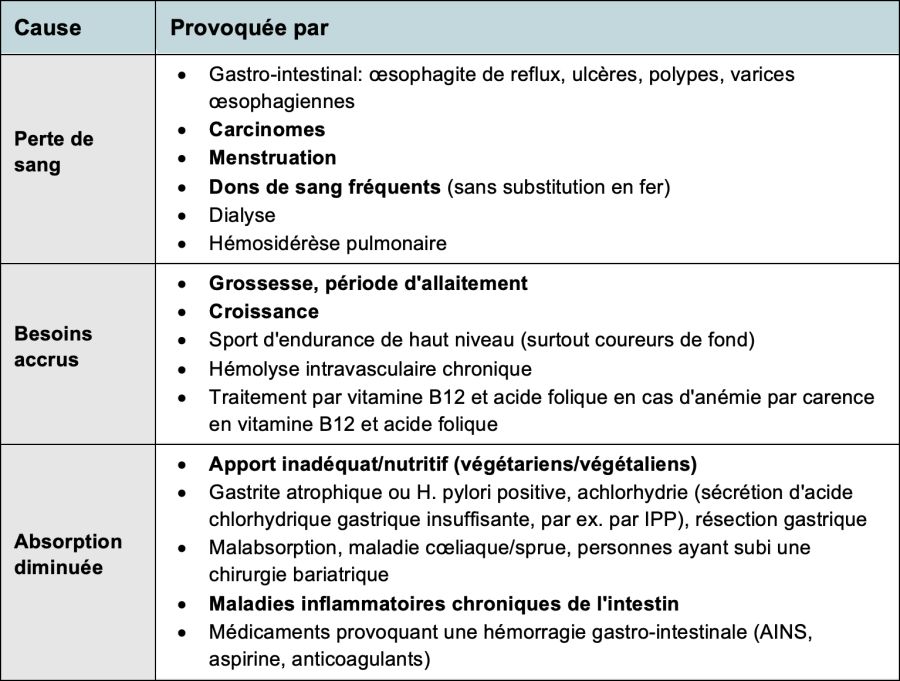
Remarque: les causes les plus importantes/fréquentes sont mises en évidence.
Symptômes
L'apparition de symptômes dépend de la durée et la gravité de la carence en fer.
- Signes généraux (apparition en fonction de la gravité et la durée)
- Faiblesse musculaire et diminution de l'endurance, fatigue, irritabilité, vertige
- Troubles cognitilfs (manque de concentration, capacité d'apprendre réduite, troubles de la mémoire)
- Maux de tête, dyspnée d'effort, tachycardie, thermorégulation réduite, appétit pour l'argile et la terre.
- Peau et muqueuses
- Pâleur (signe douteux) de la peau et des muqueuses (en particulier des conjonctives, signe plus fiable)
- Ongles striés, ongles cassants, chute de cheveux, peau sèche, prurit, aphtes, rhagades, rhagades aux coins de la bouche.
Remarques sur la fatigue et l'anémie
- Il n'y a pas de relation entre la fatigue „isolée“ et l'anémie dans l'ensemble de la population (8–10). D'autre part, chez les femmes préménopausées souffrant de carence en fer sans anémie, la fatigue peut être atténuée/supprimée par un traitement à base de fer (11) – mais de manière significative seulement si la ferritine est < 15 ng/ml (11, 12). Pour le traitement de la carence en fer sans anémie voir chap. 4.2.
- En cas de fatigue inexpliquée, penser également à d'autres maladies déclenchantes avant le traitement au fer, par ex. dépression, hypo-/hyperthyroïdie, insuffisance rénale, diabète, hyperparathyroïdie, hépatite chronique, etc. (13). Voir aussi mediX GL Fatigue.
3. Diagnostic
3.1. Diagnostic de laboratoire
Les paramètres suivants sont nécessaires: hémogramme, ferritine sérique, CRP (15).
Anémie ferriprive
- Hb < 12 g/dl (femmes), < 13 g/dl (hommes); anémie légère: Hb 9–12 g/dl, anémie sévère: 6–7 g/dl
- Ferritine (valeurs limites partiellement controversées)
- < 15 ng/ml: indique l'épuisement des réserves en fer
- 15–30 ng/ml: carence en fer avec réserve de fer réduite
- 30–50 ng/ml: réserve de fer suffisante en l'absence d'inflammation concomitante
⇒ On peut supposer une carence en fer lorsque la ferritine sérique est < 15 ng/ml, avec les symptômes correspondants (15, 20, 21). Chez les patients souffrant de certaines maladies chroniques, les valeurs limites diffèrent (voir ci-dessous la section „Dépistage“)
- Chez les patients hématologiques et oncologiques, la saturation de la transferrine peut être déterminée en complément de la ferritine (valeurs „inflammatoires“ souvent élevées). Une diminution de la saturation de la transferrine signifie que l'érythropoïèse ne dispose pas de suffisamment de fer. Cela peut arriver en cas de valeurs inflammatoires élevées, même si les réserves de fer sont bien remplies.
⇒ Une saturation de la transferrine (TSAT) ≤ 20 % est considérée comme diagnostique d'une carence en fer – même en cas de néoplasies, insuffisance cardiaque et insuffisance rénale chronique (15, 22).
Remarque: le fer sérique comme paramètre diagnostique d'une carence en fer est désuet.
Diagnostic différentiel
Une anémie microcytaire hypochrome peut également être présente dans des formes légères d'anémies héréditaires telles que l'alpha- ou la bêta-thalassémie ou en cas de maladies chroniques.
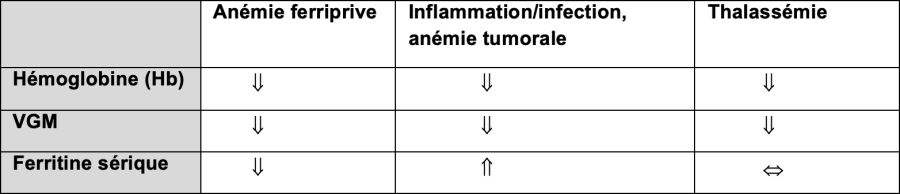
A noter: les anémies inflammatoires, infectieuses et tumorales sont souvent normochromes, la carence en fer combinée avec une carence en vitamine B12 peut être normocytaire!
3.2. Détermination des causes
La carence en fer (l'anémie ferriprive) n'est qu'un symptôme et son étiologie devrait être clarifiée en premier lieu
- Nutritif (végétarien/végétalien)?
- Donneur de sang?
- Hyperménorrhée?
- Prise d'aspirine®, d'AINS, de Marcoumar® (hémorragie gastro-intestinale chronique)?
- Sprue oligosymptomatique avec symptômes gastro-intestinaux (perte de poids, diarrhée, douleurs abdominales)? –> clarifier avec les IgA transglutaminases tissulaires et les IgA totales.
En l'absence d'indices anamnestiques clairs, il convient d'exclure en priorité les maladies malignes et les maladies inflammatoires chroniques du tractus gastro-intestinal. En l'absence de suspicion concrète, clarification en fonction de lâge
- Patients < 50 ans: d'abord une gastroscopie avec biopsie de l'intestin grêle (question de la sprue), si aucun résultat –> coloscopie
- Patients > 50 ans: d'abord capteur de CO ou coloscopie, si aucun résultat
–> gastroscopie.
Dépistage
- Il n'est pas recommandé un dépistage généralisé de la carence en fer sans symptômes correspondants
- Les patients souffrant d'insuffisance cardiaque présentent souvent une anémie concomitante (env. 55 % en cas d'insuffisance chronique). C'est pourquoi ces patients devraient être examinés annuellement au point de vue anémie ferriprive. Selon la directive ESC Guideline 2021 un déficit en fer est constaté lorsque la ferritine sérique est < 100 ng/ml, mais cette valeur limite est controversée
- Les patients souffrant d'anémie inflammatoire chronique (érythrocytes hypo- à normochromes, saturation de la transferrine < 20 %, paramètres inflammatoires [+]), par ex. d'une maladie inflammatoire chronique de l'intestin, devraient être régulièrement dépistés pour une carence en fer (il n'existent pas de recommandations générales sur les intervalles précis de dépistage). Si la ferritine sérique est < 30 ng/ml, il s'agit d'une carence en fer absolue nécessitant un traitement
- En cas d'insuffisance rénale chronique, la carence en fer doit être dépistée périodiquement selon les recommandations néphrologiques (28), chez les patients sans anémie et un DFGe estimé de ≥ 45 ml/min/1,73 m2 annuellement, en cas de DFGe < 45 ml/min/1,73 m2 au moins 2 fois par an. Chez les patients souffrant d'anémie (mais sans médicaments stimulant l'erythropoïétine): en cas d'anémie légère et un DFGe ≥ 45–60 ml/min/1,73 m2 tous les 6 mois, en cas de maladie rapidement progressive, d'anémie sévère et un DFGe < 45 ml/min/1,73 m2 tous les 3 mois. Les valeurs limites de fer en fonction du degré d'insuffisance rénale sont controversées.
4. Thérapie
4.1. Nutrition
L'apport en fer peut être augmenté par une alimentation riche en fer, ce qui permet de prévenir une carence en fer. En cas de carence en fer existante, il faut en général recourir à une substitution médicamenteuse supplémentaire.
- Besoins en fer
- Apport alimentaire par jour
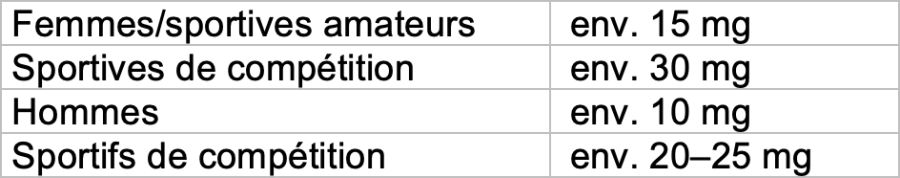
- Apport alimentaire par jour
- Nutrition
- Le fer animal est présent à environ 40–90 % sous forme de fer héminique divalent bien absorbable (myoglobine, hémoglobine, cytochromes) qui, grâce à un transporteur propre, peut être absorbé beaucoup plus efficacement que le fer non héminique d'autres aliments. Le „fer des légumes“ se présente sous forme trivalente et ne peut être absorbé qu'après réduction en Fe2+
- Le Fe3+ n'est pas absorbable à un valeur pH > 3. Pour être résorbable, il y a besoin d'acide gastrique et/ou d'acide ascorbique (cave: traitement avec IPP)
- Le fer non héminique (fer libre) peut être favorisé ou inhibé dans sa résorption.
- La résorption est favorisée par
- Les aliments fermentés (pH bas), par ex. la choucroute
- Les acides organiques (agrumes et autres fruits, jus de fruits au repas).
Remarque: contrairement aux hypothèses précédentes, la vitamine C ne semble pas avoir d'influence notable sur l'absorption du fer (24).
- La résorption est inhibée par
- Les phytates: par ex. le son (substance contenue dans l'enveloppe extérieure du grain; elle fixe plusieurs nutriments dans l'intestin, comme le fer, le zinc, le calcium et le magnésium, qui sont ensuite éliminés sans être digérés
- L'oxalate (épinards)
- Les composés polyphénoliques (thé noir, café, tisanes, cacao, vin rouge, origan)
- Calcium (lait): données variables au point de vue inhibition de l'absorption du fer.
- Les bonnes sources de fer sont (tableau complet sur la teneur en fer des aliments, voir iron.medline)
- Viande (la viande de muscle rouge contient le plus de fer assimilable), foie
- Légumes secs (soja, lentilles, pois chiches)
- Noix et graines (pistaches, amandes, noisettes, graines de tournesol, graines de lin)
- Céréales (surtout complètes)
- Légumes et herbes (persil, cresson de fontaine, pissenlit, oignons, salsifis)
- Les ustensiles de cuisine en fonte augmentent la teneur en fer des aliments.
- La résorption est favorisée par
4.2. Substitution du fer
Indication
- Toute anémie ferriprive est une indication de substitution du fer
- Une étude contrôlée par placebo (2020) chez des donneurs de sang avec un déficit en fer, mais sans anémie a montré que la supplémentation en fer par v.i. n'affectait ni la fatigue ni d'autres symptômes, tels que qualité de vie réduite, capacité de travail réduite, troubles cognitifs, sautes d'humeur et „jambes sans repos“ (20). On peut donc se demander si, somme toute, une carence en fer sans anémie doit être traitée
- En cas de carence en fer sans anémie et de valeurs initiales de ferritine > 15 ng/ml, une substitution en fer n'est pas indiquée (5, 6, 15, 16, 20), car son utilité n'est pas suffisamment prouvée. Il en va de même pour les patients souffrant du syndrome des jambes sans repos (14, 20) –> voir aussi mediX GL Troubles du sommeil (chap.5)
- En cas de carence en fer sans anémie et des valeurs de ferritine < 15 ng/ml, une substitution en fer peut être envisagée au cas par cas, même si son utilité est douteuse
- Une substitution en fer lorsque les réserves de fer sont remplies (ferritine normale) n'est pas indiquée et peut être nocive (6, 25).
Substitution de fer en présence de comorbidités
- Insuffisance cardiaque: chez les patients symptomatiques présentant une FEVG < 45 % et une carence en fer (définie par une ferritine sérique < 100 ng/ml), la guideline ESC 2021 recommande une thérapie intraveineuse à base de fer-carboxymaltose (Ferinject®). L'étude AFFIRM-HF (2020) a montré qu'une thérapie à base de fer réduisait le risque d'hospitalisation chez ces patients. Le critère d'évaluation primaire défini pour cette étude – la combinaison de décès cardiovasculaire et de réhospitalisation en raison d'insuffisance cardiaque – n'était toutefois pas statistiquement significative. Voir aussi mediX GL Insuffisance cardiaque (chap. 4, section Substitution du fer)
- Maladies inflammatoires chroniques de l'intestin (MICI): chez les patients atteints de MICI avec anémie inflammatoire et un taux de ferritine sérique < 30 μg/l, le fer devrait être substitué (27). L'utilité d'une thérapie à base de fer chez les patients atteints de MICI et présentant un déficit en fer sans anémie est controversée et n'a pas été prouvée à ce jour (–> Guideline ECCO /consensus)
En cas de besoin thérapeutique: la thérapie ferrique orale et intraveineuse est possible, la décision doit être prise individuellement. La thérapie intraveineuse de fer est judicieuse en cas de réaction inflammatoire aiguë prononcée, d'augmentation inadéquate de l'Hb sous thérapie orale et en cas de taux d'Hb bas avec le souhait d'augmentation rapide de l'Hb (–> Universimed) - Anémie rénale –> voir mediX GL Insuffisance rénale chronique (chap. 3.5). Les valeurs limites pour un traitement sont controversées
- Femmes enceintes: valeur limite inférieure de l'Hb < 11 g/dl (au 2e trimestre
< 10,5 g/dl); une ferritine sérique < 30 ng/ml est une indication de traitement pendant la grossesse, même s'il n'y a pas (encore) d'anémie (19). Justification: besoins accrus de fer pendant la grossesse, perte de sang pendant l'accouchement et besoins accrus pendant l'allaitement.
Dosage et administration

Règle générale pour la dose de fer nécessaire en fonction de la valeur initiale de la ferritine (5)
Ferritine sérique
- < 10 ng/ml –> dose totale cumulative de 1'000 mg de fer
- 10–30 ng/ml –> dose totale cumulative de 500 mg de fer
- 30–50 ng/ml –> une dose de 200 mg de fer.
Remarque: en cas d'une anémie ferriprive, le besoin en fer devrait être calculé, à part ça il suffit de se référer à la règle générale.
1. La substitution orale reste l'administration standard.
Dosage
- Chez l'adulte, 100–150 mg un jour sur deux (meilleure résorption du fer que lors d'une prise quotidienne [17]). Prise au moins 30 min avant le repas (chez les patients sensibles à l'estomac pendant/après le repas, mais la résorption est alors un peu moins bonne)
- Chez les personnes très âgées (≥ 80 J.), on peut aussi choisir une faible dose (16). Une étude pertinente a montré qu'une dose quotidienne de 15 mg de fer s'est avérée aussi efficace que des doses comparatives de 50 mg et 150 mg, mais est nettement mieux tolérée (18)
- Chez les femmes désirant devenir enceintes, il est recommandé une substitution supplémentaire en acide folique.
Médicaments
- Fe2+: Tardyferon®, Ferrum Hausmann®
- Fe3+: l'unique forme orale est le Maltofer® (un peu mieux toléré que le Fe2+, mais résorption un peu moins bonne).
Effets secondaires: les effets secondaires gastriques (nausées) ou la constipation limitent assez souvent le traitement –> réduire la dose de fer; le passage à la forme de gouttes peut éventuellement atténuer les effets secondaires.
Contre-indications: anémies avec taux de ferritine normaux, hémosidérose et hémochromatose avec taux de ferritine élevés.
2. La substitution de fer par voie intraveineuse peut être utile lorsque le fer oral n'est pas toléré ou insuffisamment absorbé, ainsi que chez les femmes enceintes, les personnes souffrant de maladies inflammatoires chroniques de l'intestin et ceux souffrant d'une maladie rénale chronique (16)
- Avec 100 mg de fer, la ferritine peut être augmentée d'environ 10 ng/ml. Administration intraveineuse stricte (utiliser Venflon)!
- Administrer Ferinject® (fer-carboxymaltose) en perfusion courte (dilué dans une solution saline physiologique): 500–1'000 mg dans 250 ml de NaCl 0,9 % et durée minimale de perfusion 15 min. Dosage: 20 mg de fer/kgPC. Lors d'une première perfusion de fer, ne pas dépasser 500 mg. En cas de bonne tolérance connue, il est possible d'administrer 1'000 mg au cours de l'évolution si les besoins sont élevés. Comme alternative à Ferinject® on peut également administrer Monofer® (maltosoïde) avec une efficacité et une tolérance comparables. Dosage Monofer®: dose max. par jour 20 mg/kgPC (durée de perfusion au moins 15 min pour les doses jusqu'à 1'000 mg, pour les doses
> 1'000 mg durée de perfusion 30 min ou plus) - Monofer® ne nécessite pas de dose d'essai. Coûts: un peu moins cher que Ferinject® (différence de prix CHF 5.– / CHF 12.– pour 500 mg voire 1'000 mg)
- La dose maximale hebdomadaire de 1'000 mg de fer ou de 20 mg/kgPC de fer ne doit pas être dépassée! Détails dans: Fiche d'information sur la perfusion de fer (exemple Feinject®). Il n'y a pas de limite de dose de 1'000 mg pour le Monofer®
- Perfusions de fer pendant la grossesse: seulement dès le 2e trimenon.
Effets secondaires
- Les réactions anaphylactiques graves sont extrêmement rares (< 1:1‘200‘000 doses), mais graves quand elles surviennent (26). Les réactions transitoires non allergiques sont des symptômes de Flush, des palpitations, des malaises, des vertiges, des myalgies et la fièvre (concerne 0,5–1 % des perfusions). Des perfusions de fer répétées peuvent entraîner une surcharge en fer et les complications associées
- Chez les patients avec insuffisance rénale chronique sous traitement par des substances stimulant l'érythropoïèse, on devrait renoncer à de nouvelles perfusions de fer si la saturation de la transferrine est > 30 % ou la ferritine est > 500 ng/ml (23)
- Les perfusions de fer peuvent entraîner des hypophosphatémies généralement passagères, mais dans certains cas graves (29–31).
Remarques:
Les hypophosphatémies sont plus fréquentes et plus prononcées sous Ferinject que sous Monofer. La pertinence clinique des ces résultats de laboratoire n'est toutefois pas encore claire. Dans aucune des études, les résultats cliniques pertinents n'étaient clairement corrélés aux taux de phosphate mesurés (30, 31).
⇒ mediX recommande
- Pas de détermination de routine du phosphate avant une perfusion de fer
- Chez les patients qui, après une perfusion de fer, présentent une fatigue plus importante qu'avant la perfusion ou une fatigue générale, ou qui ont des troubles respiratoires ou des effets secondaires gastrointestinaux, une hypophosphatémie cliniquement significative en pourrait être la raison. Dans ces cas, il est recommandé de mesurer préalablement le phosphate dans le plasma
- Si une autre perfusion de fer est prévue, mediX recommande de mesurer préalablement le phosphate afin de mieux pouvoir choisir la préparation pour la perfusion de fer.
Procédure en cas d'effets secondaires
Mesures d'urgence en cas de réactions graves (anaphylactiques) (–> mediX Plan d'urgence)
En cas de réactions moins graves (sans hypotension, tachycardie, tachypnée, stridor, œdème périorbitaire)
- Arrêter la perfusion et observer le patient (sans administrer quelconque médication)
- Si les symptômes régressent, continuer la perfusion (= évolution la plus fréquente)
- Si les symptômes s'aggravent –> traiter comme une réaction grave
- Si les symptômes persistent, appliquer de la méthylprednisone par v.i., attendre 30 minutes et recommencer la perfusion.
Que faire en cas d'allergie à une préparation intraveineuse à base de fer et besoin d'une nouvelle perfusion de fer?
⇒ Essayer une autre préparation (voir aussi la section „préparations intraveineuses à base de fer“ dans Universimed)
ou
⇒ Traitement préalable avec de la prednisolone et un antiallergique sous surveillance accrue (de préférence en hospital).
4.3. Contrôle du traitement
⇒ Il n'y a pas de consensus sur la durée de la substitution en fer
- En cas de carence en fer symptomatique non anémique, la durée de la substitution peut être déterminée sur la base de la ferritine et de l'état de santé
- En cas de carence en fer anémique, les réserves de fer doivent également être remplis par la substitution en fer (ferritine sérique: 50–100 ng/ml).
Contrôles en cas d'anémie ferriprive (6)
- L'hémoglobine après 4 semaines (devrait avoir augmentée d'env. 2 g/dl)
- Contrôles supplémentaires de l'Hb: toutes les 4 semaines jusqu'à la normalisation du taux de l'Hb
- Détermination de la ferritine: 6–8 semaines après la dernière prise de fer pour contrôler les réserves de fer, en cas de traitement par voie intraveineuse après 12 semaines.
5. Littérature
- Looker AC, et al.: Iron deficiency – United States, 1999–2000. Morb Mortal Wkly Rep. 2002;51:897–99.
- Galan P, et al.: Determinig factors in the iron status of adult women in the SU.VI.MAX.study. Eur J Clin Nutr. 1998;52:383–8.
- Schleiffenbaum BE, et al.: Unexpected high prevalence of metabolic disorders and chronic disease among young male draftees – the Swiss Army XXI experience. Swiss Med Wkly 2006; 18: 175–184.
- Sempach JS: Ernährungsgewohnheiten und Nährstoffstatus von jungen Frauen in Zürich (Dietary patterns and nutrient intake in young women in Zürich). PhD thesis. Zurich: Swiss Federal Institute of Technology Zürich, 1995: 1–144.
- Clénin G, et al.: Consensus statement of the Swiss Society of Sports Medicine. Iron deficiency in sports – definition, influence on performance and therapy. Swiss Med Wkly. 2015;145:w1419 Swiss Medical Weekly, 2015.
- Clénin G: The treatment of iron deficiency without anaemia (in otherwise healthy persons). Swiss Med Wkly. 2017;147:w14434 Swiss Medical Weekly, 2017.
- Masche U.P: Eisentherapie. Pharma-kritik, Ausgabe 17/2006.
- Wood MM, Elwood PC: Symptoms of iron deficiency anaemia. A Community survey. Brit J Prev Soc Med 1966; 20: 117.
- Elwood PC, Waet, et al.: Symptoms and circulating haemoglobin level. J Chron Dis 1969; 21: 615-28.
- Knottnerus JA, Knipet, et al.: Unexplained Fatigue and Hemoglobin: A Primary Care Study. Can Fam Physican 1986; 32: 1601-4.
- Krayenbühl P-A, Battegay E, et al.: Intravenous iron for the treatment of fatigue in nonanemic, premenopausal women with low serum ferritin concentration. Blood. 2011;118(12):3222-3227.
- Von Drygalski A, Adamson JW: Ironing out fatigue. Blood 2011;118(12):3191–2.
- Martius F: Eisenmangel ohne Anämie. Nicht hämatologische Auswirkungen des Eisenmangels: Welche sind belegt, wann kommen sie zum Tragen? Schweiz Med Forum 2009; 9(15-16):294-299.
- Trotti LM, Bhadriraju S, Becker LA: Iron for restless legs syndrome. Cochrane Database of Systematic Reviews 2019, https://doi.org/10.1002/14651858.CD007834.pub3
- Schrier SL: Causes and diagnosis of iron deficiency and iron deficiency anemia in adults. UpToDate, aufgerufen 06/2022.
- Schrier SL, Auerbach M: Treatment of iron deficiency anemia in adults UpToDate, aufgerufen 06/2022.
- Stoffel NU, et al.: Iron absorption from oral iron supplements given on consecutive versus alternate days and as single morning doses versus twice-daily split dosing in iron-depleted women: two open-label, randomised controlled trials. Lancet Haematol. 2017;4(11):e524. Epub 2017 Oct 9.
- Rimon E, et al.: Are we giving too much iron? Low-dose iron therapy is effective in octogenarians. Am J Med.2005 Oct;118(10):1142-7.
- Schweizerische Gesellschaft für Gynäkologie und Geburtshilfe (SGGG): Diagnostik und Therapie der Eisenmangelanämie in der Schwangerschaft und postpartal. SGGG, 1/2017.
- Keller P, et al.: The effects of intravenous iron supplementation on fatigue and general health in non-anemic blood donors with iron deficiency: a randomized placebo-controlled superiority trial. Sci Rep 10, 14219 (2020). https://doi.org/10.1038/s41598-020-71048-0.
- Garcia-Casal MN, et al.: Serum and plasma ferritin as an index of iron deficiency and overload. Cochrane Database of Systemic Reviews 2021, Issue 5.
- Gattermann N, Muckenthaler M, Kulozik AE, Metzgeroth G, Hastka J: The evaluation of iron deficiency and iron overload. Dtsch Arztebl Int 2021; 118: 847–56. DOI: 10.3238/arztebl.m2021.0290.
- Tichelli A: Gegenwärtiger Stand der intravenösen Eisentherapie. Sept. 2019.
- Li N, et al.: The Efficacy and Safety of Vitamin C for Iron Supplementation in Adult Patients With Iron Deficiency Anemia: A Randomized Clinical Trial. JAMA Netw Open. 2020;3(11):e2023644. Epub 2020 Nov 2.
- Shah AA, et al.: Risk of Infection Associated With Administration of Intravenous IronA Systematic Review and Meta-analysis. JAMA Netw Open. 2021;4(11):e21sued33935.
- Dave CV, et al.: Risks for anaphylaxis with intravenous iron formulations. A retrospective cohort study. Ann Intern Med. 29 March 2022 https://doi.org/10.7326/M21-4009.
- Resál T, Farkas K and Molnár T (2021): Iron Deficiency Anemia in Inflammatory Bowel Disease: What Do We Know? Front. Med. 8:686778.
- Berns JS: Treatment of anemia in nondialysis chronic kidney disease. UpToDate, aufgerufen 06/2022.
- Schaefer B, Tobiasch M, Viveiros A, et al.: Hypophosphataemia after treatment of iron deficiency with intravenous ferric carboxymaltose or iron isomaltoside—a systematic review and meta-analysis. Br J Clin Pharmacol. 2021; 87: 2256–2273. https://doi.org/10.1111/bcp.14643.
- Fragkos KC, Sehgal V, Rogers J, et al.: Hypophosphataemia after intravenous iron therapy with ferric carboxymaltose—Real world experience from a tertiary centre in the UK. GastroHep. 2020; 2: 205– 214. https://doi.org/10.1002/ygh2.415.
- Zoller H, Wolf M, et al.: Hypophosphataemia following ferric derisomaltose and ferric carboxymaltose in patients with iron deficiency anaemia due to inflammatory bowel disease (PHOSPHARE-IBD): a randomised clinical trial. Gut. 2023 Apr;72(4):644-653. doi: 10.1136/gutjnl-2022-327897. Epub 2022 Sep 9. PMID: 36343979; PMCID: PMC10086283.
6. Mentions légales
Cette guideline a été rédigée en juillet 2022. Dernière mise à jour: mai 2023
© Association mediX schweiz
Editrice
Prof. Dr. med. Corinne Chmiel
Rédaction
Prof. Dr. med. Corinne Chmiel
Dr. med. Uwe Beise
Dr. med. Felix Huber
Dr. med. Maria Huber
Auteurs
Prof. Dr. med. Corinne Chmiel
Dr. med. Uwe Beise
Cette guidance a été élaborée sans influence externe, avec la collaboration de tous les réseaux de médecins régionaux mediX et des réseaux de médecins associés en Suisse. Il n'existe aucune dépendance financière ou de contenu vis-à-vis de l'industrie ou d'autres institutions ou groupes d'intérêts.
Les guidelines mediX contiennent des recommandations d’actions thérapeutiques pour certains types de plaintes ou de situations de traitement. Chaque patient doit cependant être traité en fonction de sa situation individuelle.
Les guidelines mediX sont élaborées et contrôlées avec le plus grand soin, mais l’association mediX schweiz ne peut pas garantir l’exactitude – en particulier des indications de dosage.
Toutes les guidelines mediX sur Internet sous www.medix.ch
L’association mediX schweiz est un regroupement d’un résaux de médecins et de médecins en Suisse.
Association mediX schweiz, Sumatrastr.10, 8006 Zurich
Veuillez envoyer vos réactions à: